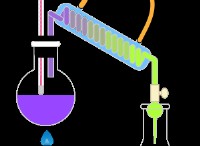
전기 분해는 전기 에너지가 화학 에너지로 변하는 과정입니다. 화학적 변화를 일으키는 전류를 통과합니다.
ex. (i) 수소로의 분해.
(ii) 물의 산소로의 분해.
전기 분해
전기 분해를 위해 주로 필요한 구성 요소는 전해질, 전극 및 외부 전원입니다. 전기 분해의 프로세스는 일반적으로 2 개의 전극 음극과 양극을 함유하는 전해 세포에서 수행됩니다. 이 두 전극은 직류 전류 및 전해질에 연결됩니다. 전극은 금속과 반도체로 구성됩니다.
전기 분해 문제 및 해당 솔루션
질문 1. 직경이 14cm이고 1 미터 길이의 철 파이프는 아연 질산염 용액을 사용하여 0.01cm의 두께로 아연 도금되어 25 A의 전류를 찾으십시오.
아연의 밀도는 7.14g/cm3입니다. 아연의 동등한 중량은 32.8입니다.
ans. 코팅 할 아연의 질량 =v * d (여기서 'V'는 아연의 부피) 아연의 부피 =2RXL * 0.01 cm3 (여기서 'r'은 반경이고‘L’은 길이입니다.
=2*22/7*14/2*1000*0.01
=440 g
이제 양극에서 손실 된 아연의 질량 =440 g
Faraday의 첫 번째 전기 분해 법칙,
전기 분해의 첫 번째 법칙
m =eq/96485
=eit/96485 (여기‘m’은 질량입니다.‘e’
so,
t =96485 * m/e * i
=96485 * 440/32.8 * 25
=51772 sec. 또는 14.4 시간
질문 2. 193 분에 대해 K2SO4의 희석 수성 용액을 통해 전류가 전달 될 때 STP에서 생성되는 O2 (g) 및 H2의 부피가 생성됩니다.
ans. 전류 =30 a
time =193 min
전류의 수량 =193 * 60 * 30 =347400 콜럼버스.
=347400/96500
=3.6 Faraday.
1 몰의 수소 및 0.5 몰의 산소 (파라데이 법에 의해)
3.6 몰의 수소에서 전기의 3.6 전기와 (3.6 * 0.5) =1.8 몰의 산소.
.그래서, stp =3.6 * 22.4 =80.64 리터의 수소 부피.
stp에서 산소의 부피 =1.8 * 22.4 =40.32 리터
질문 3. Ni (No3) 2의 솔루션에서 20 a의 전류를 사용하여 20 a에서 20 a의 니켈 금속을 도금 할 수있는 니켈 금속의 질량
ans. 주어진,
i =12 a
time =20*60 =1200 s
Charge =12 * 1200
=14400 c
반응에 따라
ni2 + (aq.) + 2e → ni (s)
(2 * 96487) c =58.7 g
.14400 c =58.7 * 14400/2 * 96487
의 니켈 퇴적물=40,779 g
질문 4. 용융 NaCl의 전기 분해 중에, 2 a 전류를 사용하여 0.10mol의 염소 가스를 생산하는 데 필요한 시간.
ans. i =3 a
2Cl → Cl2 +2e
w =e/96500 * it
0.1 * 71 =35.5/96500 * 3 * t
t =76.570 (약) sec.
질문 5. 전류에 의해 NaCl 용액에서 6 시간 안에 10g의 염소가 진화하는 경우
ans. 2CL → Cl2 +2e
2f → 1mol of cl2
10/35.5 → 10/35.5*2f
10 * 2/35.5 =변경/96500 =6 * 60 * 60 * I/96500
i =4 A. (대략)
질문 6. 20 A 전류의 경우 Alcl3의 솔루션에서 50.00 g Al을 플레이트하는 데 얼마나 걸립니까?
ans. 먼저 그램을 쿨롱으로 변환하십시오.
50.00 g al * 1 mol/26.98 g * 3/1 al * 96500/1 mol
=563,500 c
이제 필요한 시간을 계산하십시오
i =q/t
20,00 a =563,500 c/t
=281.75 sec.
질문 7. 동일한 양의 전기는 용융 AL2O3 및 용융 NACL을 포함하는 두 셀을 통해 전달됩니다. 1.6g의 Al이 한 세포에서 해방 된 경우, NA의 양은 다른 세포에서 해방된다.
ans. 언제, 27g의 al → 3f
1.8 g → 1.6/27 * 3f
이제 생산 된 두더지의 수
전기 =1.6/27 * 3 * 23
mass =1.164 g
질문 8. 구리의 밀도는 8.94 g/cm3입니다.
ans. 구리의 부피는 =20 * 10 * 10-2 =2 cm3
입니다.밀도 =질량/볼륨
구리의 질량은 =8.94 g
입니다cu2 + + 2e → 2 mol f
63.5 g → 2 mol f
8.94 g → 2/63.5 * 8.94 =0.28 f
질문 9. 600 분 안에 전류 10A를 통과하는 용융 mgcl2by의 전기 분해로 증착 된 마그네슘의 질량을 계산하십시오.
ans. Mg의 질량 =(24 * 193 * 600 * 60)/(2 * 96500)
=4.168g
질문 10. 3.50 a의 전류는 4.00 분의 와이어를 통과합니다.
ans. 와이어를 통과하는 전류 =3.50 a
i =q/t
3,50 a =q/180 sec.
q =51.42 c
질문 11. 음극이 HG 전극 인 경우 용액에서 아말감의 최대 질량을 찾으십니까?
ans. NA + 1E + HG → NAHG
2.0 몰의 NaCl은 2 몰의 NA 용액에 존재합니다.
2 몰의 질량 nahg =2 (23 + 200)
=446 g
결론
전극 및 외부 전원. 전기 분해의 프로세스는 일반적으로 2 개의 전극 음극과 양극을 함유하는 전해 세포에서 수행됩니다. 이 두 전극은 직류 전류 및 전해질에 연결됩니다. 전극은 금속과 반도체로 구성됩니다.