산화는 원자가 산소 및 물과의 반응에서 전자를 잃을 때의 과정입니다. 갈색 사과 또는 녹슬 힌 자전거는 산화를 볼 수있는 일반적인 장소입니다.
산화는 일반적인 현상입니다. 갈색 사과 또는 녹슨 자전거는 모두 산화 반응의 일반적인 예입니다. 산화는 산소 원자가 화합물에 첨가된다는 것을 의미하지는 않습니다. 대신, 그것은 전자의 손실을 포함하는 화학 반응입니다. 금속은 일반적으로 전자를 쉽게 잃을 수있는 요소로 간주되므로 쉽게 산화되는 것으로 알려져 있습니다.
이 잃어버린 전자는 우주에서 겨냥하여 방황하지 않습니다. 다른 원자에 의해 취해집니다. 하나의 원자가 전자를 수용하면 감소 반응이라고합니다 . 산화 및 환원은 함께 진행되며 공동으로 산화 환원 반응이라고합니다.
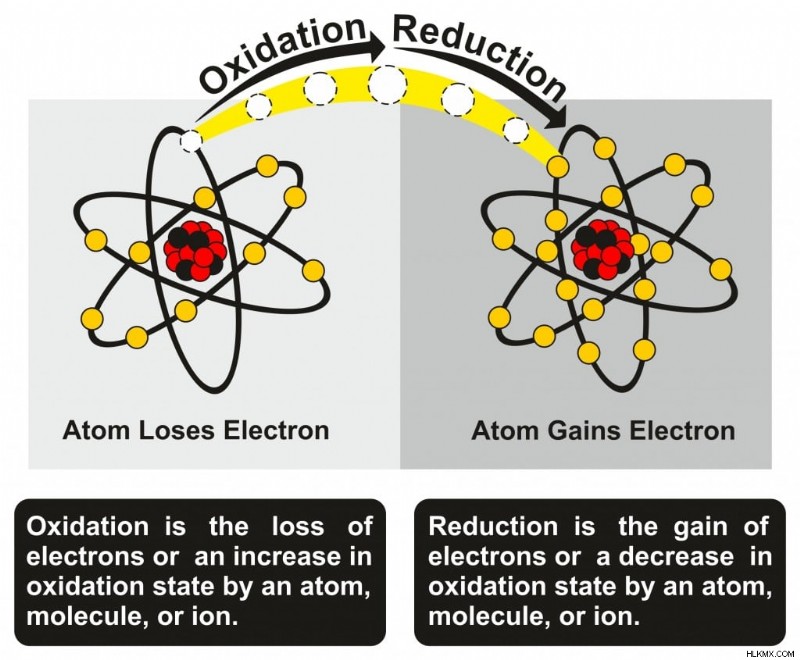
산화 및 환원 반응. (사진 크레딧 :UDAIX/ShutterStock)
산화와 감소를 기억하는 간단한 방법은 오일 리그입니다. 산화는 전자의 손실이며 감소는 전자를 얻는 것입니다. 나중에 감사 할 수 있습니다!
일을 더 쉽게하기 위해이 특정 기사에서 산화 반응 만 논의 할 것입니다.
산화 번호/상태 란 무엇입니까?
원자는 전자를 잃을 때 산화된다고합니다. 손실 될 전자의 수는 원자 또는 분자의 산화 수에 따라 다릅니다.
산화 수 또는 산화 상태는 원자의 전하입니다. 양수, 음수 또는 0 일 수 있습니다. 산화 숫자는 항상 분자의 실제 전하에 해당하는 것은 아닙니다.
원자는 원소 상태에있을 때 산화 수가 0입니다. 이 원자의 상태는지면이 제로 구성되거나 중립 상태 일 때입니다. 나트륨에는 11 개의 전자가 있습니다. 이것은 그라운드 제로 상태입니다. 본질적으로, 원자가 항상 화합물을 형성하기 위해 전자를 얻거나 잃는 경향이 있기 때문에 산화 수는 거의 0이 아닙니다.
산화 수는 원자의 전기성에 따라 다르며, 이는 주기율표의 위치에 의해 미리 정해집니다. 일반적으로 테이블의 왼쪽에있는 요소는 전기 음성이 적으므로 전자를 쉽게 잃을 수 있습니다. 결과적으로, 그들은 양의 산화 수를 가지고 있습니다. 그룹 I 요소는 화학 결합을 형성하면서 원자가 전자를 잃어 버리기 때문에 일반적으로 산화됩니다. 산화 수는 +1입니다. 원자가 전자는 원자의 가장 바깥 쪽 쉘의 전자입니다.
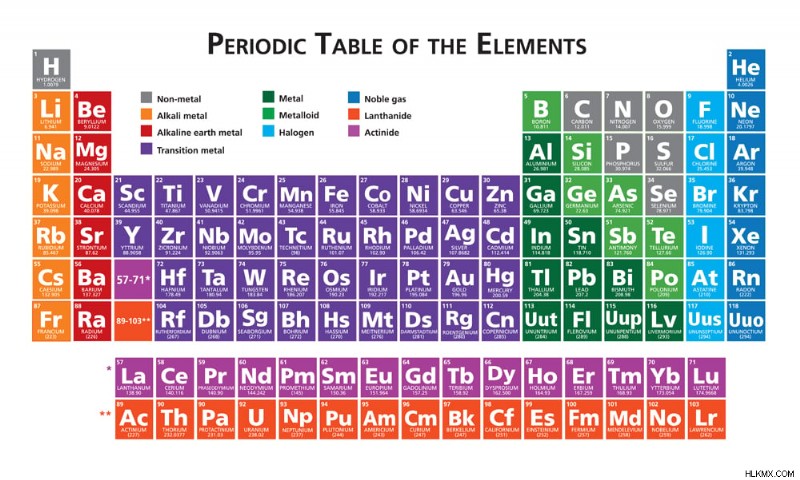
주기적 테이블. (사진 크레디트 :Julie Deshaies/Shutterstock)
이 요소의 특성은 테이블의 오른쪽으로 이동할 때 변경되며, 여기서 요소는 전자를 얻는 경향이 있으며 산화 수가 음의 경향이 있습니다. 예를 들어, 전기 음성이 뛰어나고 일반적으로 감소 반응을 겪는 halogens를 복용하십시오. 그들은 고귀한 가스와 유사한 구성을 갖기 위해 하나의 전자를 얻습니다. 이것은 그들에게 -1의 산화 상태를 남깁니다. 산화 수는 전자를 잃는 것과는 달리 2 개의 전자를 얻었으므로 음성입니다.
수소 원자에 관해서는지면에서 전자가 하나만 있고 전자를 얻거나 잃을 수 있습니다. 이것은 수소 A +1 또는 -1 산화 상태를 제공합니다. 수소 원자는 상호 작용하는 요소에 따라 환원제 또는 산화제 일 수 있습니다.
산화제와 환원제 란 무엇입니까?
산화제는 다른 물질을 산화시키는 물질입니다. 이것은 다른 물질이 산화를 겪을 수 있음을 의미합니다. 더욱 분해하기 위해, 산화제가 반응에 존재할 때, 반응의 다른 원자가 전자를 잃게한다. 이 손실 된 전자는 산화제에 의해 받아 들여집니다. 결과적으로 산화제를 전자 수용체 이라고합니다 .
이것은 당신이 누군가를 고용하여 일을하고 당신의 shouders에서 일부를 꺼내는 것과 같습니다. 이 외부 에이전트는 업무 부담을 당신에게서 멀어지게하고 그 과정에서 과도하게 작업하게됩니다.
다시 말해, 환원제는 반응에서 다른 물질이 감소하는 데 도움이되는 물질이다. 환원제는 물질이 전자를 얻는 데 도움이됩니다.
전자를 얻는 원자는 산화제 라고합니다. , 다른 원자가 전자를 잃고 산화를 겪을 수 있으므로. 한편, 전자를 잃는 원자는 다른 원자가 전자를 얻고 감소를 겪게하기 때문에 환원제이다.
.약어 오일 리그로 돌아가십시오. 이 근본적인 이해가 없으면 프로세스를 완전히 이해하기가 어려울 것입니다.
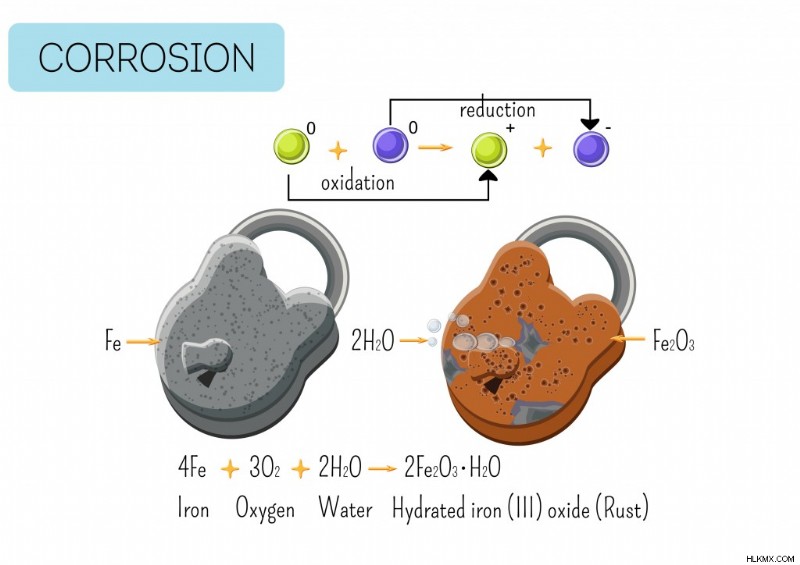
철근은 어떻습니까?
녹 또는 산화철은 산화의 가장 일반적인 예입니다. 반짝이는 금속 (철)은 산소 및 물과 반응 할 때 갈색 층을 개발합니다. 소금이 금속을 빠르게 부식시키는 경향이 있기 때문에 해수에서 반응이 더 빠릅니다. 이것은 전자의 전자가 2 가지 물질 사이에서 발생하는 전기 화학 반응으로 인한 것입니다. 고체와 액체.
건조한 공기에서는 녹이가 발생하지 않지만 대신 공기가 물을 동반 할 때 발생합니다. 습도는 철의 녹슬 때 중요한 요소입니다.
간단한 반응은 다음과 같습니다.
철 + 물 + 산소 수화 철 산화철
보다 구체적으로, 반응은 다음과 같습니다.
2fe2 + + 4oh – → 2fe (OH) 2 (철 하이드 록 사이드)
반응은 철의 이온과 수산화 이온 (수소 및 산소)을 포함하며, 이는 철분 수산화철을 제공하기 위해 반응합니다.
.이 철 하이드 록 사이드는 산소와 추가로 반응하여 녹슬 었습니다, Fe2O3.
물과 산소에 노출 될 때 철분의 부식. (사진 크레딧 :Inna Bigun/Shutterstock)
공기 중에 존재하는 유리 산소 가스 (O2) 및 이산화탄소 (CO2)는 녹 형성을위한 산소 공급원이 될 수 있습니다. 녹이가 정착되면 금속이 더욱 저하되기 시작하여 결국 부서지기 쉬워지고 사용하기에 적합하지 않습니다.
결론
오래된 녹슬 낸 자전거에 작별 인사를해야 할 때가되었지만 여전히 다른 금속 품목에 대한 희망이 있습니다. 예를 들어 손목 시계의 다이얼은 스테인레스 스틸로 만들어졌으며 자전거와 거의 같은 운명을 갖지 않습니다. 스테인레스 스틸은 금속 표면을 공기와 물에서 분리하여 수년간 지속될 수 있으므로 품목이 부식을 방지합니다.
.스테인레스 스틸은 합금으로 여러 다른 요소와 함께 금속의 조합임을 의미합니다. 그것은 철, 크롬, 망간, 실리콘, 탄소 및 경우에 따라 소량의 니켈과 몰리브덴으로 구성됩니다. 이들 요소는 물이 존재하는 경우 산소와 반응하여 얇고 안정적인 필름을 형성한다. 이 필름은 공기와 물에 대한 장벽을 세워서 부식을 방지합니다.
산화는 나쁘지 않고 제거하기 어려운 환영받지 못한 손님입니다. 다행히도 금속성을 적절하게 관리하면 산화를 예방하거나 느리게하는 데 도움이 될 수 있습니다. 윤활제 또는 보호 코팅을 적용하는 것은 도움이 될 수 있지만, 이것은 완벽하지는 않습니다.
자연에서 발생하는 산화 반응의 영향을 피할 수는 없습니다. 유일한 방법은 예방 조치를 취하기 위해 예방 조치를 취하거나 확산을 완화하는 것입니다!