탄소 양이온은 불완전한 옥틴으로 인해 매우 반응성이 높고 불안정하여 몇 가지 특성을 지정합니다. 탄수화물은 평범한 용어로 8 개의 전자를 가지고 있지 않으므로 옥트 규칙을 만족시키지 않습니다.
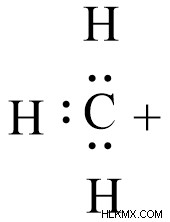
탄소에서, 탄소는 삼각 평면 형상을 형성하는 SP2 하이브리드 화된다. 탄소의 외부 전자 구성은 6 개의 전자를 포함하고 빈 P 궤도는 전자 결핍을 보여줍니다. 이로 인해 전자 결핍 종이라고하며 일반적으로 전기성으로 알려져 있습니다.
탄수화물은 일반적으로 SN1 반응, 제거 반응 및 기타 화학 반응에서 볼 수 있습니다.
탄수화물 분류
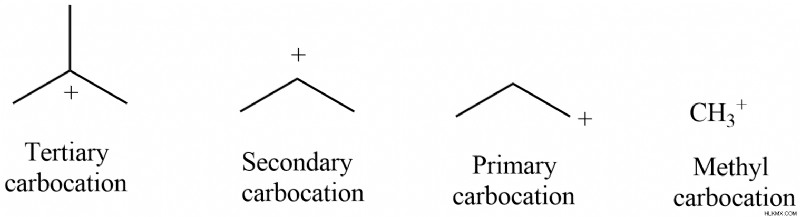
탄소에 연결된 탄소 그룹의 양은 탄수화물의 이름을 결정합니다. 연결된 탄소 원자의 수를 기준으로 탄소는 메틸, 1 차, 2 차 또는 3 차로 분류 될 수 있습니다 :
1. 메틸 카보로 위치 :탄소가 양성 차 탄소에 연결되어 있지 않으면 단순히 메틸 탄수화물이라고합니다.
2. 1 차 탄수화물, 2 차 탄수화물 및 3 차 탄수화물은 각각 1, 2 또는 3 개의 탄수화물이 양전하로 탄소에 연결될 때 형성됩니다.
3. 알릴 탄수화물은 양전하가있는 탄소 옆의 탄소 탄소 이중 결합으로 정의됩니다.
4. 마찬가지로, 양의 차전한 탄소가 이중 결합에 연결된 경우, 탄수화물을 비닐 탄수화물로 알려진다. 양의 차전한 탄소의 혼성화는 SP이고 지오메트리는 선형입니다.
5. 양전하가있는 탄소가 벤젠 고리에서 발견되면, 탄수화물을 아릴 탄수화물이라고합니다.
6. 벤질 탄수화물은 벤젠 고리 바로 옆에있는 양전하가있는 탄소로 정의됩니다.
놀랍게도이 두 가지 외에 피라미드 탄소로 알려진 다른 유형의 탄수화물이 있습니다. 이 유형의 이온은 피라미드처럼 보이는 4면 또는 5면 다각형을 가리키는 것을 선호하는 단일 탄소 원자로 구성됩니다. 4면 피라미드 이온의 전하는 +1이지만 5면 피라미드의 충전은 +2입니다.
탄수화물 형성
카보이션은 아래에 나열된 두 가지 기본 절차 중 하나를 사용하여 만들 수 있습니다.
1. 탄소 결합의 절단.
2. 전자 첨가
1. 탄소 결합의 절단
탄소와 원자 사이의 링크가 절단되면 잎 그룹은 공유 전자를 제거합니다. 결과적으로, 탄소 원자는 전자가 빈약하다. 따라서, 양전하가 발생하여 탄수화물이 형성됩니다. 활성화 에너지의 가치가 낮을수록 채권 절단 또는보다 안정적인 탄수화물의 생성 경향이 클 것입니다.
탄수화물은 SN1 및 E1 반응과 같은 수많은 유기 반응에서 반응 중간체로 생성됩니다.
2. 전자 첨가
electrophile은 전자 첨가에서 불포화 지점 (이중 또는 트리플 본드)을 공격하여 PI 결합이 파손되어 탄수화물 생산을 초래합니다. 활성화 에너지가 낮을수록 첨가가 빨라질수록 탄소가 더 안정적입니다. 프로펜 (CH3CH =CH2)과의 HBR (electrophile)의 반응은 PI 결합에 전자 유전 적 첨가를 보여줍니다.
. 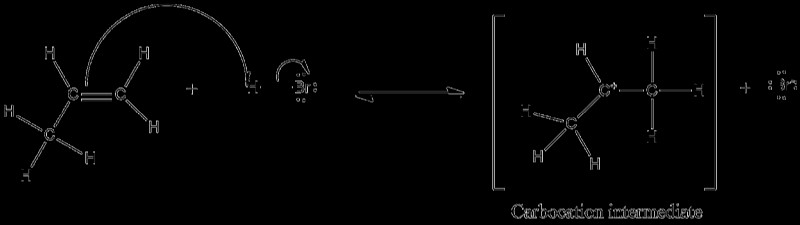
2 차 탄수화물이 공명으로 인해 2 차 탄수화물이 더 안정적이기 때문에 1 차 탄수화물 형성보다 2 차 탄수화물 형성이 선호된다고 언급해야합니다. 이것은 Markovnikov의 규칙과도 일치합니다. Alkenes, Alkynes 및 Benzene 고리는 모두 전자 첨가 반응을 겪는 것으로 알려져 있습니다.
탄소는 전자 부족, 빈 궤도 및 불완전한 옥넷 때문에 극도로 반응성입니다. 결과적으로, 안정성은 옥셋 완전성과 전자 부족의 감소에 따라 결정됩니다.
탄수화물 예제의 형성
다음 과정은 탄수화물이 안정성을 유지하는 데 도움이 될 수 있습니다.
1. 친 핵성 첨가
2. PI 본드 형성
3. 재 배열
1. 친 핵성 첨가
탄수화물은 양전하와 불완전한 옥셋을 갖는 전자 결핍 옥텍입니다. 친핵체의 포함은 양전하를 안정화시켜 새로운 공유 결합의 발달을 초래한다. 탄수화물은 그 결과로 안정화됩니다. 탄수화물은 매우 반응성이기 때문에 약한 친핵체조차도 연결할 수 있습니다. 이것은 탄수화물 안정화의 매우 일반적인 메커니즘입니다.
2. PI 결합 형성
양전하를 제거하고 옥셋을 완료하기 위해 탄수화물은 주변 수소에서 전자를 수용 할 수 있습니다. 따라서 새로운 PI 연결이 설정 될 수 있습니다. 일반적으로 모든 염기는 수소 원자를 제거해야합니다. 탄수화의 높은 반응성으로 인해 물이나 요오드화 이온과 같은 약한 염기조차도 탈 양성자 화에 도움이 될 수 있습니다. 탈 양성자화가 발생하면 두 가지 유형의 제품이 생성됩니다. 주요 제품은 더 안정적인 화학 물질입니다.
3. 재 배열
탄수화물은 근처의 수소에서 전자를 가져와 양전하를 제거하고 옥셋을 완성 할 수 있습니다. 결과적으로 새로운 PI 연결이 형성 될 수 있습니다. 일반적으로 모든 염기는 수소 원자를 제거해야합니다. 탄수화물의 높은 반응성으로 인해 물이나 요오드 이드 이온과 같은 약한 염기조차도 탈 양성자 화에 도움이 될 수 있습니다. 양성자가 탈로 톤화되면 두 가지 유형의 제품이 생산됩니다. 더 안정적 인 화학 물질은 주요 제품입니다.
결론
탄수화물은 다른 유형의 양이온과 구별되어야합니다. 따라서, 탄수화물은 전자가 없기 때문에 양전하가있어 탄소가 두 개를 더 받아 들일 수 있음을 암시합니다. 이것은 우리가 일반적으로 만나는 다른 양이온의 탄수화뿐만 아니라 루이스 산으로 구별됩니다.