연관은 화학의 간단한 용어로, 더 큰 실체를 형성하기 위해 둘 이상의 물질을 함께 첨가하는 것을 보여줍니다. 개별 분자 실체, 이온 또는 화학 물질을 응집으로 조립할 수 있습니다. 이 문구는 해리의 반전을 말합니다. 그러나 협업 또는 조정에 의한 별개의 부가 물의 생성을 설명하는 데 거의 사용되지 않습니다.
이 기사의 주요 목표는 연관성에 대한 개요와 협회의 몇 가지 예를 제공하는 것입니다. 우리는 또한 그것이 해리와 어떻게 다른지 논의 할 것입니다.
협회 개요
연관성 복합체는 연관의 결과로 형성되는 분자 응집체이다. 작은 성분에 결합하는 힘의 약점으로 인해 연관 복합체 및 동등한 단순 분자로 평형이 자주 관찰됩니다. 화학 반응에 의한 일부의 제거는 질량 행동의 법칙이 더 많은 응집체를 분리하는 방식으로 평형에 영향을 미치기 때문에, 평형 혼합물은 소분자 단독과 화학적으로 유사하게 작용한다.
.연관성을 유발하는 다양한 유형의 힘
유사한 분자를 연결하게하는 세 가지 유형의 힘이 있습니다. 이들은 수소 결합, 분자력 및 런던 세력입니다.
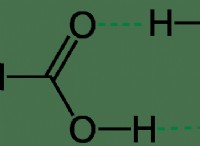
수소 결합이 가장 중요하며, 여기서 전기 음성에 연결된 수소 원자는 두 전기 음성 원자 사이의 브리지를 형성합니다. 이 두 전기 음성 원자가 별도의 분자에 있으면 다리가 그것들을 하나로 모을 것입니다. 온도가 너무 높지 않은 경우, 분자는 쌍극자 매력에 의해 함께 유지 될 수 있으며, 이는 각 분자에서 음성 및 양전하의 분리로 인해 발생합니다.
전체 분자는 극성 일 수 있으며, 절반은 과량의 양전하가 있고 다른 하나는 과량의 음전하를 갖거나 극성 그룹을 함유 할 수 있습니다. 비교적 약한 런던 세력은 충분히 저온에서 분자 부착물을 만들 정도로 강력 할 수 있습니다.
해리와 연관의 차이점은 무엇입니까?
| 협회 | 해리 |
| 연관성 복합체는 연관성의 결과로 형성되는 분자 응집체이다. 작은 성분에 결합하는 힘의 약점으로 인해 연관 복합체 및 동등한 단순 분자로 평형이 자주 관찰됩니다. 화학 반응에 의한 일부의 제거는 질량 행동의 법칙이 더 많은 응집체를 분리하는 방식으로 평형에 영향을 미치기 때문에, 평형 혼합물은 소분자 단독과 화학적으로 유사하게 작용한다. . | 화학에서, 해리는 화학 물질을 다른 조건에서 일반적으로 재결합 할 수있는 더 간단한 요소로 분해하는 것입니다. 열 형태의 에너지 또는 용매를 첨가하면 물질의 분자 또는 결정이 전해 또는 이온 성, 분리 (전기적으로 하전되는 입자)의 이온으로 분해됩니다. 화학적으로 용매와 결합하여 대부분의 해리 화합물은 이온을 만듭니다. 전기 전도성 및 전해 용액의 다른 많은 특징은 이온 분리의 개념을 사용하여 설명됩니다. |