SF4 분자 형상의 구조는 VSEPR 이론 원리를 사용하여 예측 될 수 있습니다. 결과적으로 분자에는 두 가지 유형의 F 리간드가 있습니다 :축 및 적도.
화학적 공식 ax4e를 갖는 분자의 SF4 분자 기하학 및 결합 각은 삼각형 바이 파라미드이다. 황 원자와 결합을 설정하는 2 개의 불소 원자의 적도 방향이 표시되는 반면, 다른 두 가지의 축 위치는 도시되어있다. 코어 원자에는 하나의 고독한 전자 쌍이 있으므로 결합 쌍을 회전시켜 모양을 변경하고 시소 모양을 제공합니다.
SF4 분자 형상의 중요성.
SF4 분자 형상 및 결합 각도의 중요성을 이해하는 것은 매우 중요합니다.
SF4 하이브리드 화는 무엇입니까?
원자가 결합 및 하이브리드 화는 일반적으로 함께 가르치더라도 밸런스 쉘 전자-쌍 반발 (VSEPR) 가설에 연결되어 있지 않습니다. SF4에는 하나의 고독한 쌍과 4 개의 F 시그마 본드 만 포함됩니다. S는 코어 원자입니다. 다시 말하면, 그것은 각각 하나의 고독한 쌍이있는 4 개의 본딩 구역이 있습니다.
황의 3S 궤도는 완전히 채워져 있지만 4f의 3p 궤도는 4 반으로 가득 찬 궤도 또는 각 궤도에 하나의 전자가있는 궤도가 아니기 때문에 결합을 형성하기 위해 필요합니다. 결과적으로, 3p 궤도로부터의 전자는 흥분된 황 상태의 3D 궤도에 여기되어 불소 원자와 결합하기 위해 4 개의 궤도가 남아있다.
.d 궤도는 이것과 비슷한 "과도한"화합물에 필요하지 않기 때문에 혼성화는 SF4를 생각하는 나쁜 방법입니다. 이 아이디어는 비 integer 결합에 대한 완전히 이해하기 전에 개발되었습니다.
황에서 결합은 단 하나의 고독 쌍으로 4 개의 단일 결합을 생성함으로써 발생합니다. 결과적으로 5 개의 별개의 전자 밀도 영역을 식별 할 수 있습니다.
S 원자의 5 개의 원자가 원자 궤도는 중간에 혼성화되어 5 개의 SP3D 하이브리드 궤도를 생성합니다. 2P orbitals에서는 4 개의 하이브리드 궤도가 겹치는 반면, 다섯 번째는 단 하나의 쌍이 있습니다. 입체 번호를 사용하여 원자가 보유한 하이브리드 궤도 수를 결정할 수 있습니다. 황은 5 개의 궤도를 사용합니다 :1 개의 궤도, 3 개의 3p 궤도 및 1 개의 3D 궤도
SF4의 루이스 구조
루이스 구조는 SF4 분자의 형상과 본드 각도 및 원자가 전자를 시각적으로 묘사합니다. 라인은 두 원자 사이에 생성 된 결합을 나타내며, 도트는 결합을 만들지 않는 원자가 전자를 나타냅니다. 전자의 결합 쌍은 결합의 형성에 관여하는 반면, 고독한 쌍으로도 알려진 비 결합 전자 쌍은 결합에 참여하거나 확립하지 않습니다.
.SF4의 원자가 껍질에있는 전자의 총량
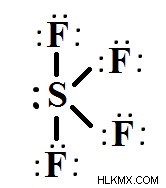
황 테라 플루오 라이드는 황과 불소의 두 가지 원소로 구성됩니다. 황은 최종 쉘 (밸런스 쉘)에 6 개의 전자가있는 원소를 통한주기적인 테이블 그룹입니다. 불소는 최종 쉘에 7 개의 전자가있는주기적인 테이블 그룹 VIIA 요소입니다.
SF4에서는 s?
의 전자 쌍 형상은 무엇입니까?SF4의 핵심 요소 인 Sulfur는 입체 번호 5를 가지며 각 불소 및 고독한 쌍에 대한 단일 링크를 보유합니다. 전자 쌍은 중앙에 고독한 쌍이있는 삼각형 이피라미드로 구성됩니다. 축 위치의 두 결합은 90도 각도를 형성하는 반면, 적도 위치에있는 것들은 120도 각도를 형성합니다. SF4 분자의 기하학 (원자의 배열로 정의)은 "시소"입니다.
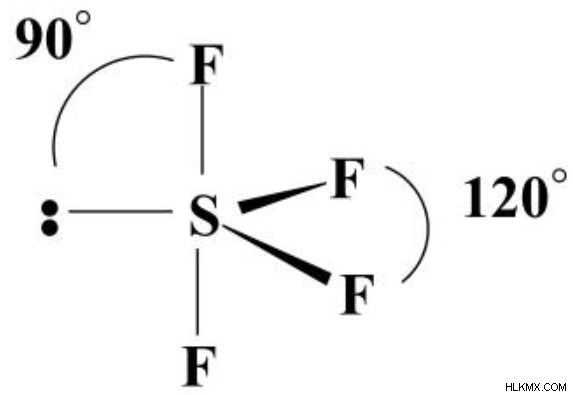
고독한 쌍이 축 방향 중 하나에있는 경우 단일 결합 중 3 개가 90도에있을 것입니다. 전자가 단지 90 도만 분리 될 때, 반발의 양은 실질적으로 더 큽니다. 각도를 분석하여 각도가 확장 될 때 반발이 크게 줄어 듭니다.
SF4는 극성 가스입니까?
두 요소의 전기 음성화를 분석하는 것은 분자가 극성인지 비극인지 여부를 식별하는 한 가지 방법입니다. 아래에 매우 유용한 주기적 차트를 포함 시켰습니다.
SF4의 전기 음성 (EN =2.98)의 차이는 1.7보다 많으며, 이는 그것이 극성 분자임을 나타냅니다.
분자가 극성인지 비극인지 여부를 결정하는 또 다른 방법은 화합물의 Lewis Dot 구조를 끌어내는 것입니다. 황 테라 플루오 라이드의 중심 원자는 2 개의 여분의 전자를 얻어 SF4 분자에 4 개의 공유 결합과 한 쌍의 비 결합 전자를 제공한다. 전기 성분이 균형을 잡지 않고 부분적인 이온 전하가 형성 될 때 전자가 고르게 분포되지 않습니다. 전기 음성의 차이가 클수록 연결이 더 많은 이온 성입니다. 부분적으로 이온 성 연결을 극성 공유 결합이라고합니다. 이것은 전자의 고르지 않은 공유를 보여주기 때문에 극성 공유 결합입니다. 반면에, 비극성 분자는 전자의 동일한 부분을 가질 것이다. 결과적으로 SF4는 극성입니다.
결론
코어 황 원자 주위에, SF4는 5 개의 전자 밀도 영역 (4 개의 결합 및 1 개의 고독 쌍)을 함유한다. 삼각형 이피라미드는 시소 구조를 생성합니다. 황 테트라 플루오 라이드는 34 개의 원자가 전자를 함유하며, 그 중 하나는 루이스 구조에서 코어 원자에 4 개의 공유 결합과 1 개의 고독한 전자 쌍을 형성한다. 각 불소 원자에는 3 개의 고독한 쌍이 있습니다. 분자 기하학 AX4E를 가지며 삼각형 이피라미드 분자 형상과 함께 톱 모양을 만듭니다. SF4는 자연에서 극성이며 SP3D 하이브리드 화를 특징으로합니다.