주요 차이 - 염산 대 황산
산은 수용액에 양성자 또는 H+ 이온을 기증 할 수있는 분자입니다. 주로 강산과 약산이라는 두 가지 유형의 산이 있습니다. 염산과 황산은 두 가지 강산입니다. 염산과 황산의 주요 차이점은 hydrochlorric acid이고 황산은 분열된다는 것입니다.
주요 영역을 다루었습니다
1. 하이드로 클로르 산
- 정의, 속성
2. 황산이란 무엇입니까
- 정의, 속성
3. 염산과 황산의 차이점은 무엇입니까
- 주요 차이점 비교
핵심 용어 :화학 공식, Diprotic, HCl, H 2 그래서 
히드로 클로르 산
히드로 염산 분자는 수소 (H) 및 염소 (CL) 원자로 구성됩니다. 염산의 화학적 공식은 hcl 로 제공됩니다. . HCl의 몰 질량은 약 36.5 g/mol입니다. 이 산은 물에 HCL 가스의 무색 용액입니다. 강한 산이기 때문에 HCl은 부식성이며 처리 할 때주의를 기울여야합니다.

그림 01 :염산
HCl은 하나의 HCl 분자 당 하나의 이온을 기증 할 수 있습니다. 즉, 단일 단일 (하나의 양성자를 방출 할 수 있음)을 의미합니다. HCl과 물 사이의 반응은 다음과 같이 제공 될 수 있습니다.
hcl +h 2 O → Cl +H 3 o
HCl은 큰 산 해리 상수 값을 가지고 있습니다 (k a ). 이 산은 적정을 통한 염기의 농도를 결정하는 데 사용된다. 높은 k a 때문에 쉽게 분리하기 때문입니다. 그리고 cl 이온은 염기의 양이온으로 소금을 형성합니다.
naoh (aq) +hcl (aq) → naCl (aq) +h 2 o (l)
위의 반응에서 Naoh는베이스이고 NaCl은 반응에서 형성된 소금입니다.
그 외에도, 염산은 온화한 환원제입니다. 그것은 mno 2 와 같은 강한 산화제와의 산화 환원 반응을 겪습니다. .
mno 2 (aq) +hcl (aq) → mncl 2 (aq) +cl 2 (g) +h 2 o (l)
황산이란 무엇입니까
황산은 수소 (h), 산소 (O) 및 황 (S) 원자로 구성된 강산입니다. 분자식 황산은 H 2 로 주어진다 그래서
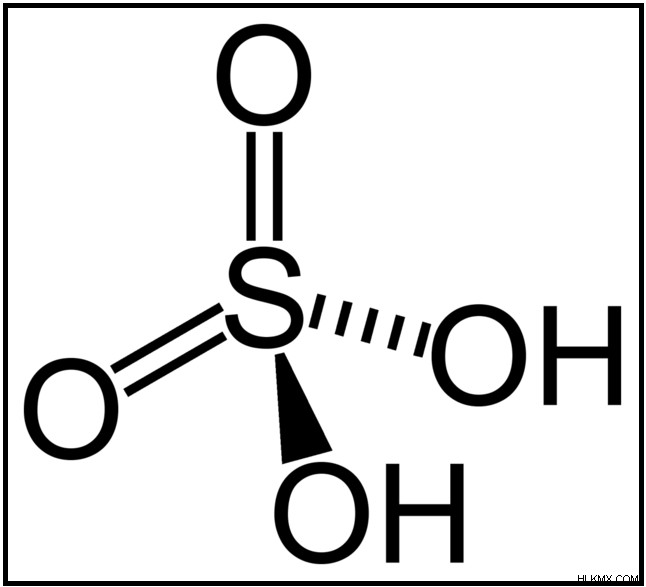
그림 01 :황산의 화학 구조
황성 분자는 매우 극성 인 두 개의 O-H 결합을 가지고 있습니다. 이러한 극성으로 인해 H 원자를 쉽게 손실 할 수 있습니다. 이온화 황산은 두 단계로 발생합니다.
h 2 So 4 (aq) +h 2 o (l) → hso 4 (aq) +h 3 o (aq)
hso 4 (aq) +h 2 o (l) → So
황산은 집중 조건에서 강한 산화제입니다. 그러나 희석되면 산화 강도가 감소합니다. 예를 들어, 더 높은 온도에서, 농축 황산은 Br로 BR을 산화시킬 수 있습니다. .
2hbr (aq) +h 2 So 4 (aq) → br 2 (aq) + So 2 (aq) +2 h 2 o (l)
염산과 황산의 차이
정의
히드로 염산 : 염산은 수소와 염소 원자로 구성된 강산입니다.
황산 : 황산은 수소, 황 및 산소 원자로 구성된 강산입니다.
몰 질량
히드로 염산 : 염산의 몰 질량은 약 36.5 g/mol입니다.
황산 : 황산의 몰 질량은 약 98 g/mol입니다.
양성자 방출
히드로 염산 : 염산은 모노 프 로컬이며 분자 당 하나의 양성자를 방출합니다.
황산 : 황산은 분포 적이며 분자 당 2 개의 양성자를 방출합니다.
–oh 그룹의 존재
히드로 염산 : 염산은 -oh 그룹이 없습니다.
황산 : 황산에는 두 개의 –OH 그룹이 있습니다.
화학적 특성
히드로 염산 : 염산은 온화한 환원제입니다.
황산 : 황산은 강한 산화제입니다.
결론
염산과 황산의 주요 차이점은 염산은 단일 염산이지만 황산은 분열된다는 것입니다. 염산과 황산은 실험실 관행에서 매우 중요합니다. 그들은 산이기 때문에 이러한 솔루션을 처리 할 때주의를 기울여야합니다.