주요 차이 - 사이클로 헥산 대 벤젠
사이클로 헥산과 벤젠은 화학 합성 공정에 많은 응용을 갖는 두 가지 중요한 유기 화합물입니다. 둘 다 6 개의 탄소 원자로 구성되며 주기적 구조입니다. 사이클로 헥산과 벤젠의 2D 화학 구조는 다소 비슷해 보이기 때문에 그들의 구조와 이름은 종종 혼란 스럽습니다. 그러나 사이클로 헥산과 벤젠에는 많은 차이가 있습니다. 사이클로 헥산과 벤젠의 주요 차이점은 사이클로 헥산은 6 개의 탄소 원자에 결합 된 12 개의 수소 원자, 각각의 탄소 원자 당 2 개의 수소 원자가 6 개의 탄소 원자에 결합 된 6 개의 수소 원자, 각 탄소 원자 당 1 개의 수소 원자를 함유한다는 것입니다. .
주요 영역을 다루었습니다
1. 사이클로 헥산
- 정의, 화학적 특성, 구조, 합성
2. 벤젠이란?
- 정의, 화학적 특성, 구조
3. 사이클로 헥산과 벤젠의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :방향족, 원자, 벤젠, 원유, 순환, 사이클로 헥산, 하이브리드 화, 옥탄가

cyclohexane
cyclohexane은 화학식 c 6 를 갖는 유기 화합물입니다. H 12 그리고 주기적 구조입니다. 사이클로 알칸입니다. 즉, 사이클로 헥산은 구조에서 이중 또는 삼중 결합이없는 포화 화합물이며 순환 화합물입니다. 따라서, 사이클로 헥산의 모든 탄소 원자는 SP 하이브리드 화된다.
사이클로 헥산의 2D 구조는 평면처럼 보이지만 실제로는 그렇지 않습니다. 사이클로 헥산의 화학 구조는 아래 이미지에 나와 있습니다. 이 구조는 의자 형태로 알려져 있습니다. 이 형태는 비틀림 균주가 최소화 된 사이클로 헥산의 가장 안정적인 구조입니다.
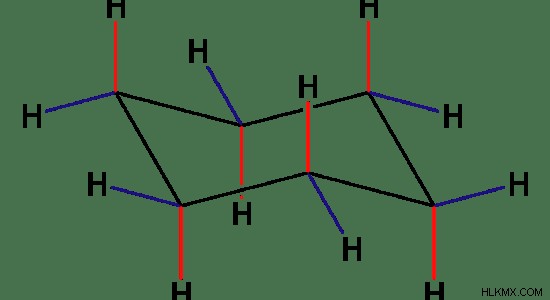
그림 1 :사이클로 헥산에는 평면 구조가 없습니다
사이클로 헥산의 몰 질량은 84.16 g/mol입니다. 실온에서 무색 액체입니다. 사이클로 헥산은 달콤하지만 휘발유 같은 냄새가납니다. 사이클로 헥산의 융점은 6.47 ° C이고 끓는점은 80.74 ° C입니다. 그것은 물에 비해 불가능하지만 에테르, 알코올 및 아세톤과 같은 용매에 용해됩니다.
cyclohexane은 원유와 같은 천연 자원에서 찾을 수 없습니다. 따라서 사이클로 헥산을 합성해야합니다. 산업 규모에서, 사이클로 헥산은 벤젠의 수소화에 의해 생성된다. 벤젠과 시클로 헥산은 6 개의 탄소 원자로 구성된 주기적 구조이기 때문에 간단하고 쉽습니다. 그러나 반응은 매우 발열 적이다.
cyclohexane은 아디 피 산과 카프로 락탐의 생산을위한 주요 원료입니다. 이 화합물은 나일론 생산에 사용되는 전구체입니다. 사이클로 헥산은 또한 실험실에서 비극성 용매로 사용됩니다.
벤젠이란?
벤젠은 화학식 c 6 를 갖는 매우 일반적이고 중요한 유기 분자입니다. H 6 . 그것은 SP 하이브리드 화 된 6 개의 탄소 원자로 구성되며,이 탄소 원자 각각은 2 개의 다른 탄소 원자 및 수소 원자에 결합된다. 따라서 평면 구조입니다. 실온에서, 그것은 무색 액체입니다.
벤젠의 어금니 질량은 78.11 g/mol입니다. 벤젠은 방향족 화합물입니다. 방향족 냄새가 있습니다. 휘발유와 같은 냄새입니다. 벤젠의 융점은 5.53 ° C이고 끓는점은 80.1 ° C입니다. 물로 오해가 아닙니다. 그러나 그것은 알코올, 클로로포름, 디 에틸 에테르 등에 용해됩니다.
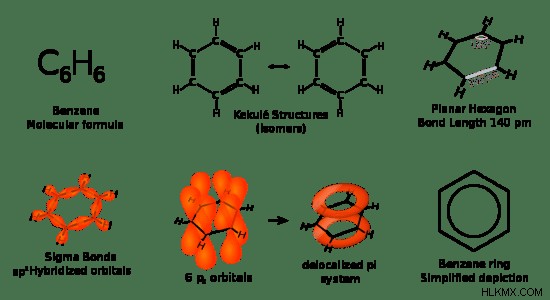
그림 2 :벤젠 사실
화학 구조에서 벤젠은 분자 평면과 평행 한 파이 전자 구름을 제거했습니다. 이것은 벤젠 고리의 각각의 탄소 원자에 존재하는 UN- 하이브리드화 된 P 궤도의 존재로 인해 발생합니다. 이 pi 궤도는 서로 혼합되어 전자 구름을 형성 할 수 있습니다.
벤젠은 자연적으로 원유에서 찾을 수 있습니다. 벤젠은 가연성이 매우 높습니다. 방향족 탄화수소입니다. 벤젠은 옥탄가가 높기 때문에 휘발유에서 중요한 구성 요소입니다. 벤젠의 주요 사용은 에틸 벤젠, 커멘 등과 같은 다른 화학 물질의 생산을위한 중간체로서 사용한다는 것입니다.
사이클로 헥산과 벤젠의 차이
정의
사이클로 헥산 : 사이클로 헥산은 화학적 공식을 갖는 유기 화합물입니다. c 6 H 12 .
벤젠 : 벤젠은 화학적 공식을 갖는 매우 일반적이고 중요한 유기 분자입니다. c 6 H 6 .
수소 원자 수
사이클로 헥산 : 사이클로 헥산은 12 개의 수소 원자를 가지고 있습니다.
벤젠 : 벤젠은 6 개의 수소 원자를 가지고 있습니다.
구조
사이클로 헥산 : 사이클로 헥산은 의자 형태를 가지고있다.
벤젠 : 벤젠은 평면 구조입니다.
몰 질량
사이클로 헥산 : 사이클로 헥산의 몰 질량은 84.16 g/ mol.
입니다벤젠 : 벤젠의 몰 질량은 78.11g/mol.
입니다용융점 및 끓는점
사이클로 헥산 : 사이클로 헥산의 융점은 6.47 ° C이고 끓는점은 80.74 ° C입니다.
벤젠 : 벤젠의 융점은 5.53 ° C이고 끓는점은 80.1 ° C입니다.
탄소 원자의 혼성화
사이클로 헥산 : 사이클로 헥산에는 SP 하이브리드 화 된 탄소 원자가 있습니다.
벤젠 : 벤젠은 SP 하이브리드 화 된 탄소 원자를 가지고 있습니다.
박대 된 pi 전자
사이클로 헥산 : 사이클로 헥산에는 비편성 PI 전자 구름이 없습니다
벤젠 : 벤젠에는 분비 된 PI 전자 구름이 있습니다.
발생
사이클로 헥산 : 사이클로 헥산은 원유에서 자연적으로 발생하지 않습니다.
벤젠 : 벤젠은 자연적으로 원유에서 발생합니다.
결론
사이클로 헥산 및 벤젠은 6 개의 탄소 사이클 구조입니다. 2D 구조는 비슷해 보이지만 매우 다른 화합물입니다. 시클로 헥산과 벤젠의 주요 차이점은 사이클로 헥산이 6 개의 탄소 원자에 결합 된 12 개의 수소 원자를 함유하고, 각각의 탄소 원자 당 2 개의 수소 원자가, 벤젠은 6 개의 탄소 원자에 결합 된 6 개의 수소 원자, 각 탄소 원자 당 1 개의 수소 원자를 함유한다는 것입니다.
.참조 :
1.“사이클로 헥산.” 국립 생명 공학 정보 센터. Pubchem Compound Database, 미국 국립 의학 도서관, 여기에서 구할 수 있습니다.
2. "벤젠." Wikipedia, Wikimedia Foundation, 2018 년 1 월 18 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. Calvero의“H와 H”. - Commons Wikimedia
2를 통한 ChemDraw (Public Domain)와 자체 제작. Vladsinger의 "Benzene 표현"-EN :파일 :Benzol Trans.png (CC By-SA 3.0)를 통해 Commons Wikimedia