주요 차이 - 단당산화물 대 이당류 대 다당류
탄수화물은 모든 살아있는 유기체의 주요 구성 요소입니다. 모든 탄수화물은 다른 조합에서 탄소 (C), 수소 (H) 및 산소 (O) 원자로 구성됩니다. 설탕은 탄수화물입니다. 주요 유형의 설탕에는 단당류 및 이당류가 포함됩니다. 다당류는 복잡한 탄수화물입니다. 단당류 이당류와 다당류의 주요 차이점은 단당류는 당의 단량체이고 이당류는 2 개의 단량체로 구성되는 반면 다당류는 다수의 단량체로 구성된다는 것입니다. .
주요 영역을 다루었습니다
1. 단당류
- 정의, 속성, 예
2. 이당류는 무엇입니까
- 정의, 속성, 예
3. 다당류는 무엇입니까
- 정의, 속성, 예
4. 단당류 이당류와 다당류 사이의 유사점
- 일반적인 기능의 개요
5. 단당류 이당류와 다당류의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :알 도스, 탄수화물, 이당류, 섬유, 케토스, 단당류, 다당류, 전분, 설탕

단당류
단당류는 단일 설탕 분자이며 이당류와 다당류의 빌딩 블록 역할을합니다. 단당류는 가장 간단한 형태의 탄수화물입니다. 이 단당류는 C, H 및 O 원자로 구성됩니다. 단당류의 일반적인 공식은 (ch 2 이다 o)
단당류는 Aldehyde 형태 또는 ketone 형태로 발견됩니다. 이것은 단당류가 본질적으로 화학 구조에 카르 보닐기를 가지고 있음을 의미합니다. 알데히드 그룹을 갖는 단당류는 알도스라고하며, 케톤 그룹을 갖는 단당류를 케토스라고한다. 알 도스에서, 카르 보닐기는 말단 탄소 원자에 위치하고 케토스에서 카르 보닐기는 두 번째 탄소 원자에 위치한다.
.당 분자에 존재하는 탄소 원자의 수에 따라 다른 유형의 단당류가 있습니다. 그것들은 그들의 이성질체와 유도체에 따라 분류됩니다. 단당류의 대부분은 동일한 분자 공식을 가질 수 있지만 다른 배열을 가질 수 있습니다.
단당류의 확인에 따르면 각 단당류 당 두 가지 유형의 이성질체가 있습니다. 그들은 D- 이성질체 및 L- 이성질체이다. 두 번째 탄소의 –OH 그룹의 위치는 단당산화물이 D- 이성질체 또는 L- 이성질체인지 여부를 결정한다. 단당류의 원자 배열을 보여주는 가장 쉬운 방법은 분자의 피셔 투영이다. 분자의 2 차원 구조입니다.

그림 01 :d- 글루코스의 피셔 투영
위의 이미지는 d- 글루코스의 피셔 투영을 보여줍니다. 그러나 단당류의 실제 구조는 3 차원 구조입니다. 이를 의자 확인이라고하며 주기적 구조입니다. 다음 이미지는 포도당의 실제 구조를 보여줍니다.
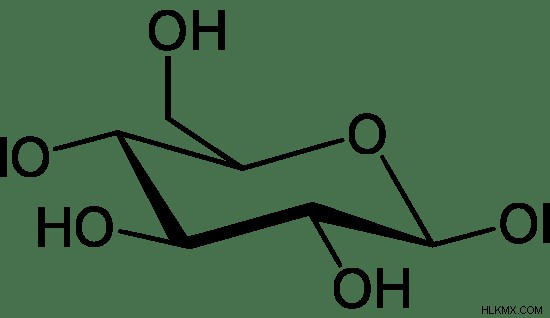
그림 02 :D- 글루코스 의자 확인
단당류는 수용성입니다. 거의 모든 단당류는 달콤하고 물에 녹일 때 무색입니다. 간단한 단당류는 선형의 브랜치 구조를 가지지 만, acyclic 형태는 불안정성으로 인해주기 형태로 전환된다. 모든 단당류는 설탕을 줄이고 있습니다.
단당류에 대한 예
- Glyceraldehyde (3 개의 탄소 원자)
- erythrose (4 개의 탄소 원자)
- 펜 토스 (5 개의 탄소 원자)
- 포도당 (6 개의 탄소 원자)
이당류
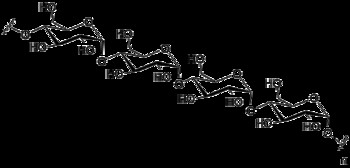
이당류는 두 개의 단당류로 구성된 당 분자입니다. 따라서 모든 이당류는 두 개의 화학 고리로 구성됩니다. 두 단당류 사이의 결합을 글리코 시드 결합이라고합니다. 이당류는 또한 단순한 설탕입니다. 이당류는 감소 강도에 따라 두 그룹으로 분류됩니다.
- 설탕 감소 - 환원제로 작용할 수 있습니다
- 비 환원 설탕-환원제로 작용할 수 없습니다
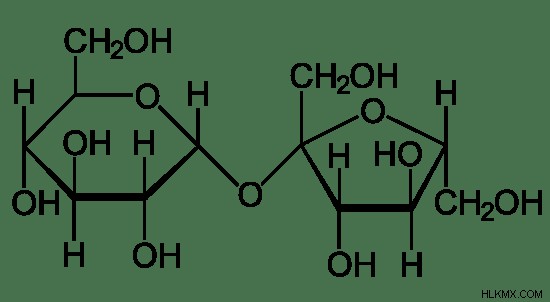
그림 03 :이당류의 구조
따라서 일부 이당류는 설탕을 줄이고 일부는 그렇지 않습니다. 모든 이당류는 물에 용해 될 때 수용성이며 무색입니다. 일부 이당류는 달콤한 시음이지만 일부는 아닙니다.
이당류 및 그 특성에 대한 예
| 이당류 | 단량체 | 강도 감소 | 맛 |
| 자당 | 포도당과 과당 | 비 환원 | 달콤한 |
| 유당 | 포도당과 갈락토스 | 감소 | 달콤한 |
| Maltose | 두 포도당 | 감소 | 달콤한 |