현대주기 테이블의 인기는 사용하기 쉬운 참조에서 비롯됩니다. 이 표는 화학 연구를 단순화했습니다. 주기적인 요소 테이블을 암기함으로써 물리적 및 화학적 특성을 추적 할 수 있습니다. 원소에 의해 형성된 화합물에 관한 예측은 표에서의 위치에 따라 결정됩니다.
주기적인 표의 현재 형태
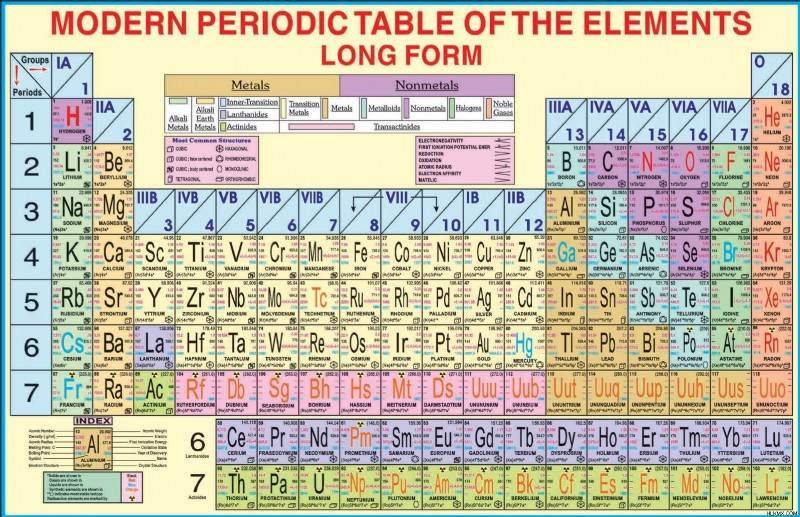
주기율의 요소 테이블은 표 형식을 사용하여 발견 된 화학 요소를 나타냅니다. 이 표에서 요소는 원자 번호의 순서가 증가하는 행 (기간) 및 열 (그룹) 아래에 배치됩니다.
러시아 화학자이자 발명가 인 Dmitri Mendeleev는 1869 년에 현대주기 테이블의 첫 번째 버전을 출판했습니다.주기 테이블은 화학과 물리학에서 수십 년의 과학적 발전을 반영하도록 진화했습니다. 현재 현재 과학에서 가장 중요한 성과는 현대주기 테이블입니다. 이 테이블은 18 개의 수직 열, 7 개의 수평 행 및 118 개의 요소로 구성됩니다.
현대주기 테이블의주기적인 트렌드는 무엇입니까?
요소의 다른 측면을 보여주는 주기적 테이블의 특정 패턴은주기적인 추세의 야심입니다. 요소의 크기 및 전자 특성이 포함됩니다. 이러한 추세는 요소와 주기적 특성 사이의 유사한 원자 구조에서 비롯됩니다.
이제 주기율표의주기적인 트렌드를 소개하자 :
· 전기 음성 트렌드 :
전자를 끌어 들이고 결합하는 능력을 설명하는 원자의 화학 특성은 전기 음성으로 정의됩니다. 그러나 질적 특성으로 인해 전기 음성을 계산하는 표준 방법은 없습니다.
화학적 결합을 형성하는 과정에서 공유 전자를 끌어들이는 주어진 화학 요소의 원자의 경향은 전기성을 정의하는 것입니다. Linus Pauling은 1932 년에 전기 음성 성의 개념을 소개했습니다. Pauling Scale은 결합의 에너지와 전기 음성 사이의 관계를 설명합니다.
왼쪽에서 오른쪽으로 기간 동안 전기 음성이 증가합니다. 그러나 이와는 반대로 그룹을 내려갈 때 동일한 감소가 발생합니다. 전자는 왼쪽에서 오른쪽으로 이동할 때 전자 차폐에 비해 핵 전하가 빠르게 증가하기 때문에 발생합니다.
· 전자 친화력 추세 :
기체상에서 중성 원자에 의해 전자를 수용하는 원자의 능력은 전자 친화력으로 정의 될 수 있습니다.
원자 또는 분자의 전자 친화력은 전자가 기체 상태에있는 중성 원자 또는 분자에 부착 될 때마다 방출 된 에너지의 양과 관련이 있어야합니다.
전자 친화력 값이 더 많을수록 전자에 대한 원자의 친화력이 높아집니다. 전자 친화력은 전자가 중성 가스 원자에 첨가 될 때 발생하는 에너지 변화를 표시하기 위해 정량적으로 측정 될 수 있습니다.
주기율표에서 전자 친화력이 왼쪽에서 오른쪽으로 증가한다는 것을 알아야합니다.
원자 반경의 감소는이를 유발합니다. 마찬가지로, 전자 친화도는 그룹 내에서 위에서 아래로 감소합니다. 다시, 이것은 원자 반경의 증가의 결과입니다.
· 이온화 에너지 트렌드 :
이온화 에너지 추세는 분리 된 원자 또는 분자에서 전자를 제거하는 데 필요한 에너지와 관련이 있습니다. 그룹을 내려 가면 이온화 에너지가 감소합니다. 이것은 전자 차폐로 인해 발생합니다. 그러나 주기율표에서 오른쪽으로 왼쪽으로 이동하면 이온화 에너지가 증가합니다. 이것은 원자가 쉘 안정성의 결과입니다.
고귀한 가스는 완전한 원자가 껍질을 가지고 있습니다. 이것의 직접적인 결과는 높은 이온화 에너지를 보유하는 것입니다. 주기율표의 모든 요소를 고려할 때, 이온화 에너지가 가장 높은 요소는 헬륨입니다.
· 원자 반경 추세 :
두 원자의 핵 사이의 거리의 절반은 원자 반경의 모든 것입니다. 그러나 모든 원자가 같은 방식으로 함께 묶이지 않기 때문에 복잡성이 작용합니다.
원자 반경은 기간 동안 왼쪽에서 오른쪽으로 감소합니다. 그것은 기간 동안 양성자와 전자의 수가 증가하기 때문입니다. 양성자는 전자보다 더 큰 영향을 미칩니다. 결과는 전자가 핵으로 당겨져 반경이 작습니다.
반면에, 원자 반경은 그룹의 위에서 아래로 증가합니다.
· 녹는 점 추세 :
요소의 용융점은 요소 상태를 고체에서 액체로 변경하는 데 필요한 에너지로 설명 될 수 있습니다. 여기서, 원자 사이의 결합이 강할수록 녹는 점이 높아집니다.
용융점이 다양하기 때문에 주기율표에서 구별 가능한 경향을 형성하지 않습니다. 그러나 독특한 패턴이 관찰 될 수 있습니다.
금속의 경우 높은 융점이 투영됩니다. 비금속은 더 낮은 융점을 가지고 있습니다. 우리는 모든 경우에 예외가 있다는 것을 알고 있습니다.
비금속 인 Carbon은 모든 요소의 가장 높은 융점을 가지고 있습니다. 또한 반 금속 붕소는 융점이 높습니다.
· 금속 문자 트렌드 :
요소의 금속 특성은 전자를 잃기 위해 원자의 준비와 관련이 있습니다. 기간에 걸쳐 왼쪽에서 오른쪽으로 금속 특성이 감소합니다. 이는 원자의 반경이 감소하기 때문에 외부 전자가 더 쉽게 이온화 할 수 있습니다.
마찬가지로 금속 특성이 그룹을 증가시킵니다. 전자 차폐로 인해 원자 반경이 증가합니다. 금속 특성은 전자를 잃는 능력과 관련이 있습니다. 이와는 반대로, 비금속 특성은 전자를 얻는 능력과 관련이 있습니다.
결론 :
현대주기 테이블의 인기는 사용하기 쉬운 참조에서 비롯됩니다. 이 표는 화학 연구를 단순화했습니다. 주기적인 요소 테이블을 암기함으로써 물리적 및 화학적 특성을 추적 할 수 있습니다. 원소에 의해 형성된 화합물에 관한 예측은 표에서의 위치에 따라 결정됩니다.
이 테이블은 풍부한 정보 소스 역할을합니다. 또한 다른 요소 간의 관계에 대한 세부 사항을 강조합니다.