주요 차이 - 반응 속도 대 속도 상수
화학 반응에는 본질적으로 제품과 반응물이 포함됩니다. 그 외에도 화학 반응이 완료 될 때까지 진행되는 데 필요한 몇 가지 중요한 조건이 있습니다. 이러한 조건에는 적절한 온도 및 압력, 이온 강도 등이 포함됩니다. 그러나 각각의 모든 화학 반응은 두 가지 용어의 반응 속도와 속도 상수를 사용하여 설명 할 수 있습니다. 반응 속도는 반응이 진행되고 일정한 속도가 반응 속도를 정량화하는 속도를 설명한다. 반응 속도와 속도 상수의 주요 차이점은 반응 속도는 반응물의 농도의 변화 또는 단위 시간당 생성물 농도의 변화 이라는 것입니다. 비율 상수는 특정 반응의 속도와 관련된 비례 상수입니다.
주요 영역을 다루었습니다
1. 반응 속도
- 정의, 속성, 예
2. 속도 상수
- 정의, 속성, 예
3. 반응 속도와 속도 상수의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :이온 강도, 생성물, 속도 상수, 반응 속도, 반응물

반응 속도
반응 속도 또는 반응 속도는 반응물의 농도의 변화 또는 단위 시간당 생성물 농도의 변화입니다. 이것은 두 가지 방법으로 얻을 수 있습니다. 하나는 반응 동안 소비 된 반응물의 농도를 해당 소비에 대해 경과 한 시간으로부터 나누는 것입니다. 다른 방법은 반응이 끝날 때 형성된 생성물의 농도를 해당 형성에 대해 경과 한 시간으로부터 나누는 것입니다. 아래와 같이 단축 될 수 있습니다.
rate =[농도] / 시간
그러나 대부분의 경우 모든 반응물은 반응에 소비되지 않습니다. 따라서, 성분의 농도는 특정 기간에 "농도의 변화"로 취해진다. 이것은 기호 δ에 의해 주어진다. 시간이 t 1 인 경우 농도가 측정되는 경우 그런 다음 t 2 에서 , 그런 다음 반응에 걸린 시간은 (t 2 입니다. -t 1 ) =시간 경과 (ΔT). 따라서 시간은 ΔT로 간주됩니다. 그런 다음 반응이 완료되기 전에도 반응 속도를 측정 할 수 있습니다.
rate =δ [반응물] / δ 시간 =δ [제품] / Δ 시간
제품을 제공하는 A와 B 사이의 반응을 고려해 봅시다. c.
a +b → c
위의 반응에서 A, B 또는 C의 농도의 변화를 결정함으로써 반응 속도를 측정 할 수 있습니다.
rate =-δ [a] / Δt
rate =-δ [b] / Δt
rate =δ [c] / Δt
a와 B의 농도 앞에 마이너스 마크가 있음을 주목하십시오. ΔT 기간 동안 반응물의 감소를 나타내는 데 사용됩니다. 그러나 C 농도 앞에는 마이너스 마크가 없습니다. 이것은 C가 소비되지 않지만 생성되기 때문에 C의 농도가 반응 내내 증가하기 때문입니다.
.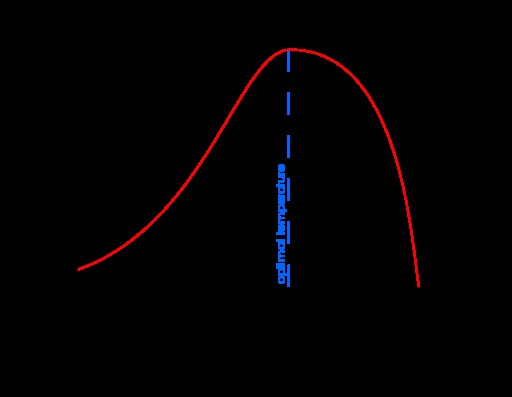
그림 1 :반응 속도 대 온도
위의 그래프는 효소 반응의 온도에 대한 반응 속도의 의존성을 보여줍니다. 최적의 온도는 반응 속도가 피크에있는 온도입니다.
rate constant
속도 상수는 특정 반응의 속도와 관련된 비례 상수입니다. 시스템의 온도에 따라 다릅니다. 속도 상수는 반응 속도에 대한 아이디어를 제공합니다. 속도 상수의 기호는 "k"입니다. 예를 들어, 제품 C를 제공하는 A와 B 간의 반응의 경우
속도 =- δ [a] / Δt
∴ 속도 α [a]
속도 =- δ [b] / Δt
∴ 평가 α [b]
위의 관계는 아래와 같이 반응 속도에 대한 방정식을 구축하는 데 사용될 수 있습니다.
rate =k [a] [b]
여기서,
k는 속도 상수입니다.
[A]는 A 의 농도입니다 [b]는 b의 농도이다a는
에 대한 반응의 순서입니다.B는 b에 대한 반응의 순서이다.
특정 온도의 경우 속도 상수는 온도의 변화에 따라 변할 명확한 값을 갖습니다. 이 온도 의존성은 "Arrhenius 방정식"이라는 방정식에 의해 제공됩니다.
k =ae
여기서,
K는 속도 상수입니다
A는 사전 지수 인자
입니다e a 반응에 대한 활성화 에너지
r은 범용 가스 상수입니다
t는 시스템의 온도
입니다이 방정식은 촉매의 영향뿐만 아니라 속도 상수에 대한 온도 변화의 영향을 나타냅니다. 온도를 높이면 속도가 상수가 증가합니다. 반응 혼합물에 촉매를 첨가하면 활성화 에너지를 감소시키고 속도 상수를 증가시킵니다.
반응 속도와 속도 상수의 차이
정의
반응 속도 : 반응 속도는 반응물의 농도의 변화 또는 단위 시간당 생성물 농도의 변화입니다.
속도 상수 : 속도 상수는 특정 반응의 속도와 관련된 비례 상수입니다.
몰 농도
반응 속도 : 반응 속도는 반응물 및 생성물의 몰 농도에 따라 다릅니다.
속도 상수 : 속도 상수는 반응물 및 생성물의 몰 농도에 의존하지 않습니다.
온도
반응 속도 : 반응 속도는 간접적으로 온도에 따라 다릅니다.
속도 상수 : 속도 상수는 본질적으로 온도에 따라 다릅니다.
시간
반응 속도 : 반응 속도는 반응에 걸린 시간에 따라 다릅니다.
속도 상수 : 속도 상수는 반응에 걸리는 시간에 의존하지 않습니다.
결론
반응 속도와 속도 상수는 특정 화학 반응에 대한 최상의 조건 (예 :온도)을 결정하는 데 매우 중요합니다. 그런 다음 반응을 쉽게 처리하고 단기간에 최적의 제품을 얻을 수 있습니다. 따라서 반응 속도와 속도 상수의 특성과 차이를 이해하는 것이 매우 중요합니다.