주요 차이 - 요율 법 대 질량 행동 법
반응물과 제품은 화학 반응의 필수 구성 요소입니다. 반응물은 화학 반응의 시작 물질로서 작용하는 화학 종이다. 반응물은 종종 불안정하고 다른 화학 반응을 겪게되어 안정적이됩니다. 때로는 반응물이 안정적이지만 온도 또는 다른 매개 변수가 변경되면 화학 반응을 겪을 수 있습니다. 제품은 화학 반응의 결과입니다. 대량 행동의 요금 법칙은 화학 반응에서 구성 요소의 행동을 설명하는 두 가지 용어입니다. 요율 법과 질량 행동 법의 주요 차이점은 반응의 반응물 만 고려하여 요금 법칙이 적용되는 반면, 대량 행동 법칙은 반응물과 반응의 생성물을 고려하여 적용된다는 것입니다.
주요 영역이 적용됩니다
1. 요금 법률
- 정의, 방정식, 속성, 예
2. 대량 행동의 법칙은 무엇입니까
- 정의, 속성, 예
3. 요율 법과 대량 행동 법의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :질량 행동, 제품, 요금 법, 반응물, 화학량 계수의 법칙 
요율 법률
요율 법은 화학 반응의 속도를 나타내는 방정식입니다. 속도 법칙의 성분은 속도 상수, 반응물 농도 및 반응물 농도에 관한 반응의 순서이다. 예를 들어, A와 B 사이의 반응은 C를 제품으로 제공 할 것임을 고려하십시오.
a +b → c
따라서이 반응의 요금 법률은
로 주어질 수 있습니다.r =k [a] [b]
여기서,
r은 반응 속도 입니다
k는 속도 constat, 입니다
[a]는 a, 의 농도입니다
[b]는 B의 농도입니다
m은 [a], 에 대한 반응의 순서입니다.
n은 [b]에 대한 반응의 순서입니다.
요금 법은 반응이 0의 순서 동역학, 1 차 운동학 또는 2 차 동역학인지 여부를 나타냅니다. 속도 상수는 시스템의 온도에만 의존합니다. 그러나 요금 법에는 제품에 대한 농도 또는 기타 세부 사항이 포함되어 있지 않습니다.

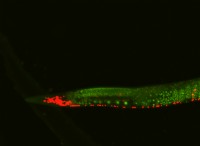
그림 1 :요오드 메트릭은 요오드와 티오 설페이트 나트륨의 반응 법칙을 결정하는 데 사용될 수 있습니다
가스의 경우 가스에 대한 농도가 주어지지 않기 때문에 농도 대신 부분 압력을 사용할 수 있습니다.
질량 법칙은 무엇입니까
질량 행동의 법칙은 화학량 계수의 힘으로 제기되는 제품의 질량과 반응물 사이의 비율을 나타내는 방정식입니다. 그러나이 이론은 현대의 발견으로 인해 수정 되었으며이 법의 수정은 화학량 계수의 힘으로 제기 된 반응물의 농도와 제품 사이의 비율을 나타냅니다.
.질량 행동의 법칙은 모든 상황에서 사용할 수 있습니다. 평형 상태에있는 시스템의 경우, 질량 행동의 법칙은 일정한 'k eq 로 주어집니다. "일정한 온도 및 압력과 같은 일정한 조건에서.
aa +bb → cc
위의 방정식의 경우, 질량 행동의 법칙은 반응물과 제품의 농도를 고려하여 다음과 같이 쓸 수 있습니다.
k eq =[c] / [a] [b]
여기서,
k eq 평형 상수입니다.
[a]는 A의 농도이고 "A"는 의 화학량 론적 계수입니다.
[b]는 B의 농도이고 "B"는 B 의 화학량 론적 계수입니다.
[C]는 C의 농도이고 "C"는 C 의 화학량 론적 계수입니다.
요율 법과 대중 행동 법의 차이
정의
요금 법 : 요금 법칙은 화학 반응의 속도를 나타내는 방정식입니다.
대량 행동 법칙 : 질량의 법칙은 화학량 계수의 힘으로 제기되는 제품과 반응물의 질량 사이의 비율을 나타내는 방정식입니다.
방정식의 구성 요소
요금 법 : 속도 법에 대한 방정식은 반응 순서와 함께 반응물의 속도 상수 및 농도로 구성됩니다.
대량 행동 법칙 : 질량 행동 법칙에 대한 방정식에는 화학량 론적 계수의 힘으로 제기 된 반응물 및 생성물의 농도가 포함됩니다.
제품
요금 법 : 반응의 산물은 요율 법에 대한 방정식에 포함되지 않습니다.
대량 행동 법칙 : 반응의 산물은 질량 행동의 법칙에 포함됩니다.
비례 상수
요금 법 : 비례 상수는 요금 법에 사용됩니다. 이것이‘k’의 속도입니다.
대량 행동 법칙 : 비례 상수는 질량 행동의 법칙에 사용되지 않습니다.
세부 사항이 주어진
요금 법 : 요금 법은 특정 반응의 비율을 제공합니다.
대량 행동 법칙 : 질량 행동의 법칙은 반응이 진행되는 방향을 제시합니다.
화학량 계수 계수
법률 : 요금 법에서, 반응물의 농도는 반응의 화학량 론적 계수와 같을 수도 있고 아닐 수있는 일부 전력으로 상승된다.
.대량 행동 법칙 : 질량 행동의 법칙에서, 반응물 및 생성물의 농도는 화학량 론적 계수의 힘으로 높아집니다.
결론
요율 법과 질량 행동 법은 반응의 화학적 동역학을 설명합니다. 따라서이 용어의 정확한 의미를 아는 것이 매우 중요합니다. 요율 법과 질량 행동 법의 주요 차이점은 반응의 반응물 만 고려하는 요금 법칙이 주어진 반면 질량 행동의 법칙은 반응의 반응물과 반응의 생성물을 고려하여 주어진다는 것입니다.
.참조 :
1. "요율 법-무한한 오픈 교과서." 무한한. Boundless, 2016 년 5 월 26 일. 웹. 여기에서 사용할 수 있습니다. 2017 년 7 월 14 일.
2.”대량 행동의 일.” Encyclopædia Britannica. Encyclopædia Britannica, Inc., n.d. 편물. 여기에서 사용할 수 있습니다. 2017 년 7 월 14 일.
이미지 제공 :
1. "요오도 메트릭 적정 혼합물"由 lhchem-commons wikimedia
를 통한 自己的作品 (cc by-sa 3.0)