주요 차이 - 실제 대 이상적인 가스
가스는 물질이 존재할 수있는 물리적 상태의 한 유형입니다. 화합물의 입자 또는 분자가 용기 내부의 어느 곳에서나 자유롭게 움직일 수 있으면이 화합물을 가스라고합니다. 기체 상태는 입자 또는 분자가 포장되는 방식에 따라 다른 두 물리적 상태 (고체 및 액체 상태)와 다릅니다. 실제 가스는 실제로 존재하는 기체 화합물입니다. 이상적인 가스는 실제로 존재하지 않지만 가상 가스 인 기체 화합물입니다. 그러나, 일부 기체 화합물은 특정 온도 및 압력 조건에서 이상적인 가스와 거의 유사한 거동을 나타낸다. 따라서 우리는 이상적인 가스라고 가정하여 이러한 종류의 실제 가스에 가스 법칙을 적용 할 수 있습니다. 적절한 조건이 제공 되더라도 실제 가스는 실제 가스와 이상적인 가스의 차이로 인해 이상적인 가스의 거동에 1000%가 될 수 없습니다. 실제 가스와 이상적인 가스의 주요 차이점은 실제 가스 분자는 분자간 힘을 가지고 있고 이상적인 가스는 분자간 힘이 없다는 것입니다.
주요 영역을 다루었습니다
1. 실제 가스는 무엇입니까
- 정의, 특정 속성
2. 이상적인 가스는 무엇입니까
- 정의, 특정 속성
3. 실제 가스와 이상적인 가스의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :가스, 이상적인 가스, 가스 법칙, 분자간 힘, 실제 가스

실제 가스는 무엇입니까
실제 가스는 환경에 실제로 존재하는 기체 화합물입니다. 이러한 실제 가스는 입자라고하는 다른 원자 또는 분자로 구성됩니다. 이 가스 입자는 일정한 움직임입니다. 가스 입자는 확실한 부피와 질량을 갖습니다. 따라서 가스는 명확한 부피와 질량을 갖습니다. 가스의 부피는 가스가 보관 된 용기의 부피로 간주됩니다.
일부 실제 가스는 원자로 구성됩니다. 예를 들어, 헬륨 가스는 헬륨 원자로 구성됩니다. 그러나 다른 가스는 분자로 구성됩니다. 예를 들어, 질소 가스는 n 2 로 구성됩니다 분자. 따라서이 가스에는 질량과 부피가 있습니다.
실제 가스 분자는 그들 사이에 분자간 관광 명소가 있습니다. 이러한 매력을 Van der Waal 상호 작용이라고합니다. 이 매력은 약합니다. 실제 가스 분자 간의 충돌은 비 탄력적입니다. 이것은 두 개의 실제 가스 입자가 서로 콜로이드를 할 때, 입자의 에너지 변화와 움직임 방향의 변화가 관찰 될 수 있음을 의미합니다.
그러나 일부 실제 가스는 저압 및 고온 조건에서 이상적인 가스로 작동 할 수 있습니다. 고온에서 가스 분자의 운동 에너지가 증가합니다. 따라서 가스 분자의 운동 속도가 높아집니다. 이로 인해 실제 가스 분자 간의 분자간 상호 작용이 줄어 듭니다.
따라서 저압 및 고온 조건에서는 실제 가스에 가스 법칙을 적용 할 수 있습니다. 예를 들어, 저압 및 고온에서;
pv / nrt ≈ 1
여기서 P는 가스의 압력입니다.
V는 가스의 부피입니다.
n은 가스의 두더지 수입니다.
R은 이상적인 가스 상수이며
입니다t는 시스템의 온도입니다.
이 값을 압축성 계수 이라고합니다 . 이상적인 가스에서 실제 가스의 특성을 벗어나기위한 보정 계수로 사용되는 값입니다. 그러나 실제 가스의 경우 pv ≠ nrt.
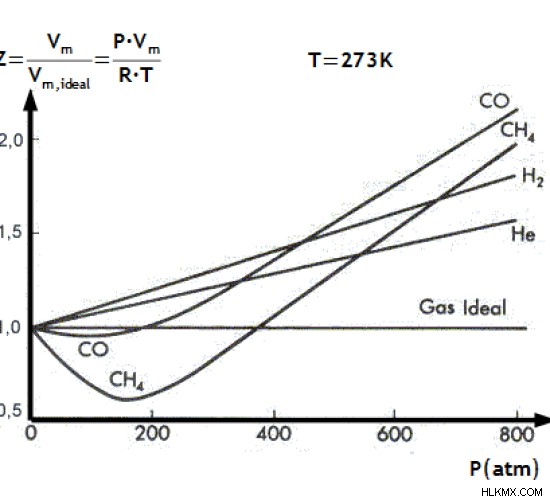
그림 1 :이상적인 가스와 관련하여 다른 가스의 압축성
PV /NRT의 값은 정확히 1과 같지 않지만 저압 및 고온 조건에서 대략 동일한 값입니다.
이상적인 가스는 무엇입니까
이상적인 가스는 환경에 실제로 존재하지 않는 가스입니다. 실제 가스의 행동이 서로 복잡하고 다르기 때문에 이상적인 가스의 개념이 도입되었으며, 실제 가스의 거동은 이상적인 가스의 특성에 대해 설명 할 수 있습니다.
.이상적인 가스는 무시할만한 부피와 질량을 가진 매우 작은 분자로 구성된 기체 화합물입니다. 우리가 이미 알고 있듯이, 모든 실제 가스는 확실한 부피와 질량을 가진 원자 또는 분자로 구성됩니다. 이상적인 가스 분자 사이의 충돌은 탄력적입니다. 이것은 운동 에너지 또는 가스 입자의 움직임 방향에 변화가 없음을 의미합니다.
이상적인 가스 입자 사이에는 매력이 없습니다. 따라서 입자는 여기저기서 자유롭게 움직입니다. 그러나, 가스 입자가 분자간 힘의 형성을 초래할 수있는 운동 에너지로 가스 입자가 서로 가까워지기 때문에 이상적인 가스는 높은 압력과 저온에서 실제 가스가 될 수있다.
.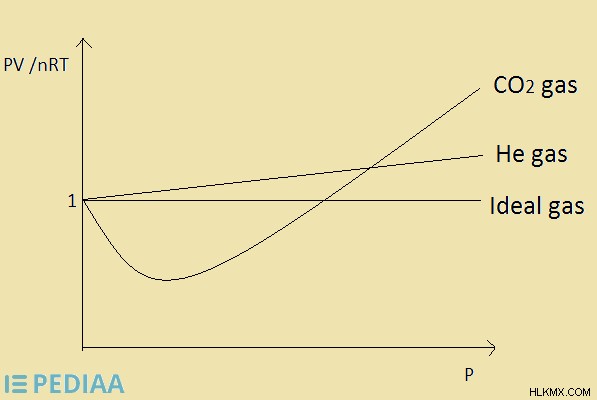
그림 2 :HE 가스 및 CO2 가스에 대한 이상적인 가스의 거동
이상적인 가스는 모든 가스 법칙에 어떤 가정없이 순종합니다. 이상적인 가스의 PV /NRT 값은 1과 같습니다. 따라서 PV의 값은 NRT의 값과 같습니다. 이 값 (압축성 계수)이 특정 가스의 경우 1과 같으면 이상적인 가스입니다.
실제 가스와 이상적인 가스의 차이
정의
실제 가스 : 실제 가스는 환경에 실제로 존재하는 기체 화합물입니다.
이상적인 가스 : 이상적인 가스는 환경에 실제로 존재하지 않는 가상 가스입니다.
분자간 명소
실제 가스 : 실제 가스 입자 사이에는 분자간 인력이 있습니다.
이상적인 가스 : 이상적인 가스 입자 사이에는 분자간 인력이 없습니다.
가스 입자
실제 가스 : 실제 가스의 입자는 확실한 부피와 질량을 갖습니다.
이상적인 가스 : 이상적인 가스의 입자는 명확한 부피와 질량을 가지지 않습니다.
충돌
실제 가스 : 실제 가스 분자 사이의 충돌은 비 탄력적입니다.
이상적인 가스 : 이상적인 가스 분자 사이의 충돌은 탄성입니다.
동역학 에너지
실제 가스 : 실제 가스 입자의 운동 에너지는 충돌로 변경됩니다.
이상적인 가스 : 이상적인 가스 입자의 운동 에너지는 일정합니다.
상태의 변화
실제 가스 : 실제 가스는 저압 및 고온 조건에서 이상적인 가스로 작동 할 수 있습니다.
이상적인 가스 : 이상적인 가스는 고압 및 저온 조건에서 실제 가스처럼 행동 할 수 있습니다.
결론
실제 가스는 환경에 실제로 존재하는 기체 화합물입니다. 그러나 이상적인 가스는 실제로 존재하지 않는 가스입니다. 이 이상적인 가스는 실제 가스의 거동을 이해하는 데 사용될 수 있습니다. 실제 가스에 가스 법칙을 적용 할 때는 실제 가스가 저압 및 고온 조건에서 이상적인 가스로 행동한다고 가정 할 수 있습니다. 그러나 정확한 방법은 가정보다는 계산에 수정 요소를 사용하는 것입니다. 실제 가스와 이상적인 가스의 차이를 결정함으로써 보정 요소를 얻습니다.