주요 차이 - 전해질 대 비 전해질
화학 화합물은 수용액을 통해 전기를 전도하는 능력에 따라 두 가지 범주로 나눌 수 있습니다. 이 두 범주는 전해질과 비 전해질입니다. 전해질은 물 형성 이온에 용해 될 수있는 화학적 화합물이다. 이 이온은 용액을 통해 전기를 전도 할 수 있습니다. 비 전해질은 물에 용해 될 때 전기를 전도하지 않는 화학 화합물입니다. 물에 용해 될 때 이온을 형성하지 않기 때문입니다. 전해질과 비 전해질의 주요 차이점은 물에 용해 될 때 전해질이 이온화 될 수 있지만 비 전해질은 물에 용해 될 때 이온화 될 수 없다는 것입니다.
주요 영역을 다루었습니다
1. 전해질은 무엇입니까
- 정의, 예제와 전해 특성의 설명
2. 비 전해질은 무엇입니까
- 정의, 예제의 일반적인 속성에 대한 설명
3. 전해질과 비 전해질의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :음이온, 양이온, 공유 화합물, 전해질, 이온 성 화합물, 이온화, 비 전해질

전해질이란?
전해질은 물에 용해 될 때 이온으로 분해 될 수있는 화합물입니다. 이 이온은이 수용액을 통해 전기를 전도 할 수 있습니다. 이온으로 분해되기 위해서는 전해질이 이온 성 화합물이어야합니다. 이온 성 화합물은 양이온과 음이온으로 만들어집니다.
물에 용해 될 때,이 이온 성 화합물은 수성 양이온과 음이온을 형성 할 수 있습니다. 이들 이온은 용액 전체에 걸쳐 균일하게 분산된다. 그러면 용액이 전기적으로 중립적입니다. 외부 에서이 용액에 전류가 제공되는 경우 용액의 이온이 움직이기 시작합니다. 양이온은 전자 밀도가 높은 전극으로 이동합니다. 음이온은 다른 전극으로 이동하는 경향이 있습니다. 이 이온의 움직임은 용액을 통해 전류를 만듭니다.
두 가지 유형의 전해질이 있습니다 :강한 전해질과 약한 전해질. 강한 전해질은 완전히 이온으로 이온화됩니다. 강한 전해질의 수용액에는 중성 분자가 없습니다. 약한 전해질은 이온으로 완전히 이온화되지 않습니다. 따라서 용액에는 일부 중성 분자가 있습니다.
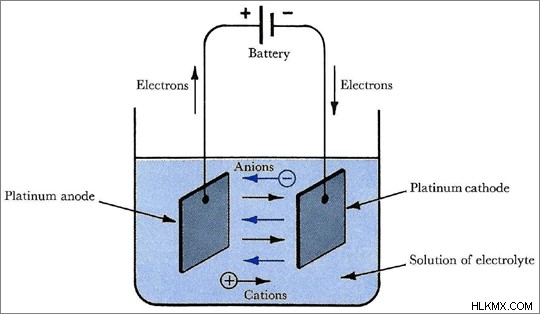
그림 1 :전해질은 전기 화학 기술 에 사용됩니다
강한 산과 강한베이스는 물에서 완전히 이온화 할 수 있기 때문에 강한 전해질입니다. 화합물이 강한 전해질로 간주되기 위해 반드시 물에 완전히 용해되어서는 안됩니다. 일부 화합물은 부분적으로 물에 용해되지만 강한 전해질입니다. 예를 들어, 하이드 록시 사이드 스트론튬, sr (OH)
약한 산과 약한 염기는 약한 전해질로 간주됩니다. 이들 화합물은 부분적으로 이온으로 분리되기 때문이다. 대부분의 질소 함유 화합물은 약한 전해질입니다. 물은 또한 약한 전해질로 간주됩니다. 물 분자는 하이드 록실 이온 및 히드로 늄 이온과 평형 상태입니다.
비 전해질
비 전해질은 수용액이 용액을 통해 전기를 전도 할 수없는 화학 화합물입니다. 이들 화합물은 이온 형태로 존재하지 않는다. 대부분의 비 전해질은 공유 화합물입니다. 물에 용해되면이 화합물은 전혀 이온을 형성하지 않습니다.

그림 2 :설탕은 물에 완전히 용해 될 수 있지만 전해질은 아닙니다.
탄화수소와 같은 대부분의 탄소 화합물은 비 전해질이기 때문입니다. 왜냐하면 이들 화합물은 물에 용해 될 수 없기 때문입니다. 포도당과 같은 일부 화합물은 물에 용해 될 수 있지만 이온화는 아닙니다. 포도당의 수용액은 포도당 분자로 구성됩니다. 따라서 설탕, 지방 및 알코올은 비 전해질입니다. 일반적으로, 비 전해질은 비극성 화합물이다.
전해질과 비 전해질의 차이
정의
전해질 : 전해질은 물에 용해 될 때 이온으로 분해 될 수있는 화학 화합물입니다.
비 전해질 : 비 전해질은 수용액이 용액을 통해 전기를 전도 할 수없는 화학 화합물입니다.
전기 전도도
전해질 : 전해질은 수용액을 통해 전기를 전도 할 수 있습니다.
비 전해질 : 비 전해질은 수용액을 통해 전기를 전도 할 수 없습니다.
화학적 결합
전해질 : 전해질은 이온 결합으로 구성됩니다.
비 전해질 : 비 전해질은 공유 결합으로 구성됩니다.
화합물
전해질 : 전해질은 이온 성 화합물입니다. 산, 염기 및 염은 전해질입니다.
비 전해질 : 비 전해질은 공유 화합물이다. 탄소 함유 화합물, 지방 및 설탕은 비 전해질입니다.
유형
전해질 : 전해질은 강한 전해질과 약한 전해질로 발견 될 수 있습니다.
비 전해질 : 비 전해질은 수용성 화합물 및 물 불용성 화합물로는 발견 될 수 없습니다.
결론
전해질과 비 전해질은 수성 솔루션을 통해 전기를 전도 할 수없는 능력에 따라 명명 된 화학 화합물입니다. 이 능력은 화합물의 이온화에 의존한다. 다시 말해, 화합물은 이온을 통해 전기를 전도하기 위해 이온으로 분해되어야한다. 전해질과 비 전해질의 주요 차이점은 물에 용해 될 때 전해질이 이온화 될 수 있지만 비 전해질은 물에 용해 될 때 이온화 될 수 없다는 것입니다.
이미지 제공 :
1.“화학 원리 그림 1.9”에 의한 원래 업로더는 ELO 1219 잉글리쉬 Wikibooks - En.wikibooks에서 Commons로 옮겨졌습니다. Commons Wikimedia
2를 통한 (CC x 3.0). APN MJM의“유리가있는 숟가락 설탕 솔루션”-Commons Wikimedia를 통한 OWN OUT (CC BY-SA 3.0)