주요 차이 - 마그네슘 대 산화 마그네슘
마그네슘은주기적인 요소 테이블의 그룹 2에있는 알칼리성 지구 금속입니다. 많은 기본 화합물을 형성 할 수 있습니다. 마그네슘은 종종 마그네슘 이발 양이온을 형성함으로써 이온 성 화합물을 형성합니다. 산화 마그네슘은 이러한 이온 성 화합물 중 하나입니다. 흰색 고체입니다. 마그네슘과 산화 마그네슘의 주요 차이점은 마그네슘이 화학 요소이고 산화 마그네슘은 이온 성 화합물이라는 것입니다.
주요 영역을 다루었습니다
1. 마그네슘
- 정의, 화학적 특성
2. 산화 마그네슘
- 정의, 화학적 특성
3. 마그네슘과 산화 마그네슘의 차이는 무엇입니까?
- 주요 차이점 비교
주요 용어 :소성, hygroscopic, 마그네슘, 수산화 마그네슘, 산화 마그네슘

마그네슘
마그네슘은 기호 mg을 가진 화학 요소입니다. 요소의 주기율표의 그룹 2, 기간 3에 배치됩니다. 마그네슘의 원자 수는 12입니다. 이것은 마그네슘이 핵에 12 개의 양성자를 가지고 있음을 의미합니다. 실온 및 압력 조건에서 마그네슘은 고체에 있습니다. 마그네슘의 전자 구성은 [ne] 3s입니다. 따라서 0 및 +2 산화 상태를 가질 수 있습니다.
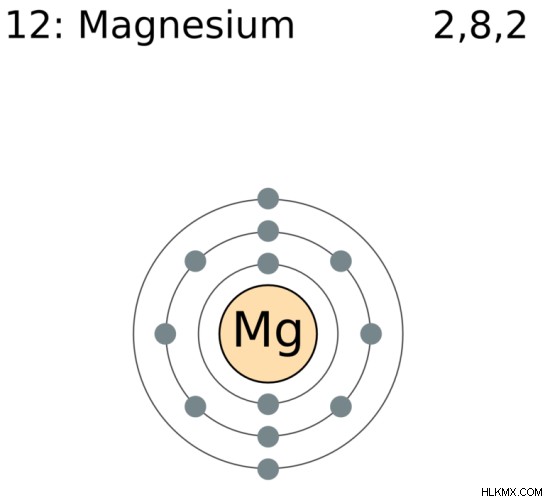
그림 1 :마그네슘의 화학 구조
마그네슘의 녹는 점은 약 650c입니다. 마그네슘의 원자 질량은 24 amu로 주어진다. 주기율표의 S 블록에 있습니다. 같은 그룹의 마그네슘 및 기타 요소는 알칼리성 지구 금속으로 간주됩니다. 이는 그들이 형성하는 산화물에 기본 특성이 있기 때문입니다. 마그네슘의 전기성은 약 1.31입니다. 마그네슘의 원자 반경은 약 160 pm입니다.
마그네슘은 주로 미네랄 퇴적물에서 찾을 수 있습니다. 이러한 미네랄에는 백운석과 마그네이트가 포함됩니다. 해수는 또한 상당한 양의 마그네슘 이온이 용해된다. 마그네슘은 특히 항공기 설계 및 자동차 설계에서 금속으로 넓은 응용 프로그램을 가지고 있습니다.
산화 마그네슘
산화 마그네슘은 화학식 mgo를 갖는 무기 화합물입니다. 이 화합물의 몰 질량은 40.304 g/mol입니다. 흡습성 인 흰색 가루입니다. 이것은 대기에 노출 될 때 공기에서 물을 흡수 할 수 있음을 의미합니다.
산화 마그네슘은 무취이며 끓는점은 3600c입니다. 이 화합물의 융점은 약 2800C입니다. 산화 마그네슘의 포화 용액은 pH 값이 10.3입니다. 따라서 기본 화합물입니다.

그림 2 :산화 마그네슘 샘플
산화 마그네슘은 격자의 마그네슘 이온과 산화물 이온으로 구성된 이온 성 화합물입니다. 양이온과 음이온 사이에는 이온 결합이 있습니다. 이 화합물을 물에 첨가하면 수산화 마그네슘을 형성합니다. 그러나 수산화 마그네슘이 가열되면 산화 마그네슘을 다시 제공합니다. 산화 마그네슘은 카보네이트 마그네슘 또는 수산화 마그네슘의 소성에 의해 생성 될 수있다.
마그네슘과 산화 마그네슘의 차이
정의
마그네슘 : 마그네슘은 기호 mg.
를 갖는 화학 요소입니다산화 마그네슘 : 산화 마그네슘은 화학식 MGO를 갖는 무기 화합물입니다.
몰 질량
마그네슘 : 마그네슘의 몰 질량은 24 g/mol.
입니다산화 마그네슘 : 산화 마그네슘의 몰 질량은 40.304 g/mol.
입니다자연
마그네슘 : 마그네슘은 화학 요소입니다.
산화 마그네슘 : 산화 마그네슘은 이온 성 화합물입니다.
용융점
마그네슘 : 마그네슘의 용융점은 약 650 ° C입니다.
산화 마그네슘 : 산화 마그네슘의 융점은 약 2800 ℃이다.
외관
마그네슘 : 마그네슘은 반짝이는 은빛 회색 외관을 가지고 있습니다.
산화 마그네슘 : 산화 마그네슘은 백색 분말입니다.
결론
마그네슘은 산화 마그네슘이 이온 성 화합물 인 화학 요소입니다. 이것은 마그네슘과 산화 마그네슘의 주요 차이점입니다. 마그네슘은 경량과 비교할 때 강도로 인해 매우 유용한 금속 요소입니다.







