주요 차이 - 형성의 열 대 반응 열
엔탈피는 화학 반응의 진행 중에 흡수되거나 진화하는 열 에너지입니다. 엔탈피에는 상징이 주어집니다. H. H는 에너지의 양을 나타냅니다. 엔탈피의 변화는 ∆H로 주어지고 기호 ∆는 엔탈피의 변화를 나타냅니다. 형성의 열과 반응 열은 두 가지 형태의 엔탈피입니다. 형성 열과 반응 열 사이의 주요 차이점은 형성 열의 열이 화합물의 형성 동안 흡수되거나 방출되는 에너지의 양이며, 반응의 열은 모든 화학적 반응 동안 흡수되거나 방출되는 에너지의 양입니다.
주요 영역이 적용됩니다
1. 형성의 열은 무엇입니까
- 정의, 방정식
2. 반응의 열은 무엇입니까
- 정의, 방정식
3. 형성 열과 반응 열의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :흡열, 엔탈피, 발열, 열, 열, 반응 열

형성 열이란?
형성의 열은 하나의 화합물이 구성 요소에서 형성 될 때 엔탈피의 변화입니다. 이것을 표준 상태에서 물질을 형성하기 위해 주어질 때 표준 형성 열이라고합니다. 표준 압력은 IUPAC에서 권장하는대로 10 PA (1 bar)입니다. 그러나 정의 된 표준 온도는 없습니다. 따라서, 형성 열은 일정한 압력에 대해 주어진다. 표준 형성 열의 기호는 ΔH f 입니다. °. 다음 방정식을 사용하여 계산할 수 있습니다. 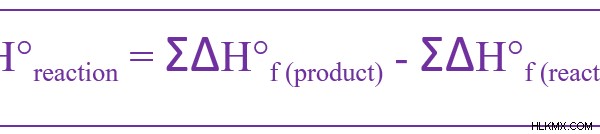
이 방정식에 따르면, 표준 형성 열은 생성물 형성의 표준 엔탈피의 합계와 반응물 형성의 표준 엔탈피 사이의 차이와 같습니다.
반응 열이란?
반응의 열은 화학 반응 중에 추가되거나 방출되어야하는 순 에너지의 순량입니다. 다시 말해, 그것은 일정한 압력에서 발생하는 화학 반응에서 엔탈피의 변화입니다. 모든 반응물을 일정한 온도로 유지하기 위해 열이 추가되거나 방출됩니다. 물질의 두더지 당 측정됩니다. 반응의 열은 다음과 같이 주어진다. 표준 상태에 대해 정의되면 반응의 표준 엔탈피라고합니다. 표준 상태는 1 막 압력과 관련 온도에서 순수한 물질입니다.

반응 열의 값이 양수 값이라면 반응이 흡열 (열이 외부에서 흡수 된)임을 나타냅니다. 그러나 반응 열의 값이 음의 값이라면, 반응이 발열 (열이 꺼진)임을 나타냅니다.
형성 열과 반응 열 사이의 차이
정의
열 형성의 : 형성의 열은 하나의 화합물이 구성 요소로부터 형성 될 때 엔탈피의 변화이다.
반응의 열 : 반응의 열은 화학 반응 중에 추가되거나 방출되어야하는 순 에너지의 양입니다.
개념
열 형성의 : 형성의 열은 화합물 형성 동안 엔탈피의 변화를 제공합니다.
열 반응 : 반응의 열은 화학 반응 동안 시스템에서 추가되거나 제거 된 열량을 제공합니다.
결론
형성 열과 반응 열은 화학 반응에 정의 된 두 가지 유형의 엔탈피입니다. 형성 열과 반응 열 사이의 주요 차이점은 형성 열이 화합물의 형성 동안 흡수되거나 방출되는 에너지의 양이지만 반응의 열은 화학적 반응 동안 흡수되거나 방출되는 에너지의 양입니다.
.참조 :
1.“표준 형성 엔탈피.” 화학 LibreTexts, LibreTexts, 2017 년 2 월 9 일, 여기에서 구입할 수 있습니다.
2. "반응의 열." Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2016 년 4 월 4 일, 여기에서 제공됩니다.
3. Helmenstine, Anne Marie. "형성 열기로 인한 엔탈피 변화에 대해 배우십시오." 여기에서 사용할 수 있습니다.