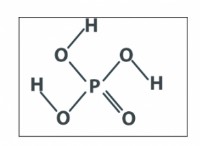
OF2는 2 개의 불소 원자에 결합 된 중심 산소 원자를 갖는다. 산소 원자는 6 개의 원자가 전자를 가지며, 각 불소 원자에는 7 개의 원자가 전자가 있습니다.
1) 원자가 전자의 총 수를 계산하십시오 :6 (O) + 2 (7 f) =20 원자가 전자.
2) 전자 쌍 지오메트리 결정 :이 20 개의 원자가 전자를 분배하려면 먼저 4 개의 결합 쌍의 전자 (각 결합에 대해 2 개)와 산소 원자에 1 개의 고독 쌍이 있어야합니다. 이 5 개의 전자 쌍은 삼각형 바이 파라미드 전자 쌍 형상을 갖습니다.
3) 분자 형상을 결정하십시오 :분자 형상은 결합 된 원자와 고독한 쌍의 위치에 따라 다릅니다. 산소 원자의 고독한 쌍은 적도 위치 중 하나를 취하는 반면, 2 개의 불소 원자는 축 위치를 점유하여 그들과 고독한 쌍 사이의 반발을 최소화합니다. 이것은 2에 구부러진 분자 형상을 제공합니다.
4) 이상화 된 결합 각도를 예측하십시오 :삼각형 비 회화물 전자 쌍 형상의 이상적인 결합 각도는 180도입니다. 하나의 고독 쌍이 적도 위치를 차지하기 때문에 불소 원자 사이의 결합 각도가 압축 될 것이고, OF2의 이상적인 결합 각도는 180도보다 약간 작습니다. 정확한 결합 각도는 실험 측정 또는 계산 방법을 통해 결정될 수 있으며 약 104 도인 것으로 밝혀졌습니다.