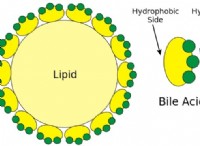
$$ P_4 + 6f_2 → 4pf_3 $$
반응의 화학량 론에서, 우리는 4 몰의 인이 6 몰의 불소와 반응 함을 알 수있다. 인의 몰 질량은 30.97 g/mol이고, 불소의 몰 질량은 18.99 g/mol입니다.
따라서, 6.20g의 인의 몰의 수는 다음과 같습니다.
$$ 6.20 \ text {g} p \ times \ frac {1 \ text {mol} p} {30.97 \ text {g} p} =0.200 \ text {mol} p $$
인의 0.200 몰과 반응하는 데 필요한 불소의 두부 수는 다음과 같습니다.
$$ 0.200 \ text {mol} p \ times \ frac {6 \ text {mol} f_2} {4 \ text {mol} p} =0.300 \ text {mol} f_2 $$
필요한 불소의 질량은 다음과 같습니다.
$$ 0.300 \ text {mol} f_2 \ times 18.99 \ text {g/mol} f_2 =5.697 \ text {g} f_2 $$
따라서, 6.20g의 인과 반응하려면 5.697g의 불소가 필요하다.