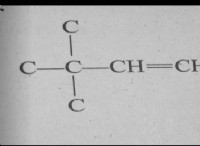
설탕 (수 크로스)은 공유 화합물이며, 이는 공유 전자에 의해 함께 보유 된 원자로 구성됩니다. 설탕의 분자간 힘은 반 데르 발스 힘입니다. 반 데르 발스 세력은 모든 분자 사이에서 발생하는 약한 매력입니다. 그것들은 분자의 전자 구름의 변동에 의해 발생하며, 이는 일시적인 양의 및 음전하를 만듭니다.
암모니아 (NH3)는 극성 공유 화합물이며, 이는 영구적 인 양의 끝과 영구적 인 음성 끝이 있음을 의미합니다. 암모니아의 분자간 힘은 수소 결합입니다. 수소 결합은 반 데르 발스 힘보다 훨씬 강합니다. 분자들 사이 의이 강력한 인력은 암모니아가 설탕보다 녹는 점과 끓는점을 갖는 이유입니다. 수소 결합은 암모니아의 분자가 서로 더 강하게 끌리게되므로 분리하기가 더 어려워집니다.
요약하면, 당은 분자들 사이의 반 데르 발스 힘이 약한 반면, 암모니아는 분자들 사이의 수소 결합이 더 강하다. 분자간 힘의 이러한 차이는 용융점 및 비등점과 같은 다른 물리적 특성을 초래합니다.