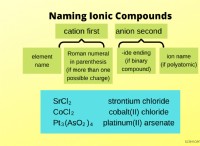
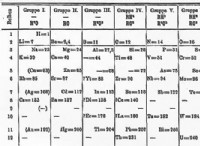
반응 속도와 반응물의 농도 사이의 관계는 다음과 같은 방정식으로 설명 할 수 있습니다.
```
rate =k [a]^x [b]^y
```
이 방정식에서, 비율은 반응의 속도이고, k는 속도 상수, [a] 및 [b]는 반응물 a와 b의 농도이고, x와 y는 각각 a와 b에 대한 반응의 순서이다.
반응물의 농도가 감소함에 따라, 속도 방정식의 해당 항은 감소한다. 이로 인해 전체 반응 속도가 감소합니다.
반응 속도는 또한 온도, 압력 및 촉매의 존재와 같은 다른 요인에 의해 영향을받을 수 있습니다. 그러나, 반응물이 소비함에 따라 반응 속도의 감소는 대부분의 화학 반응에 적용되는 일반적인 원칙이다.