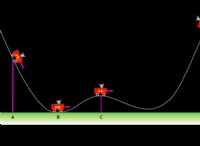
촉매는 반응에서 소비되지 않고 화학 반응의 속도를 증가시키는 물질이다. 촉매는 반응이 발생하기위한 대안적인 경로를 제공함으로써 작용하며, 이는 촉매되지 않은 반응보다 활성화 에너지가 낮다. 이는 더 많은 반응물 분자가 전이 상태에 도달하고 생성물을 형성하기에 충분한 에너지를 가지므로 더 빠른 반응 속도를 초래한다는 것을 의미합니다.
그러나, 촉매는 반응의 평형 위치를 변화시키지 않는다. 평형 위치는 평형에서 반응물 및 생성물의 상대적 농도에 의해 결정되며, 촉매의 존재에 의해 영향을받지 않는다. 이는 촉매가 전방 및 역 반응 속도를 동등하게 높이기 때문에 반응물 및 생성물의 평형 농도가 변하지 않기 때문입니다.
따라서, 혼합물에 촉매를 추가하면 H2O가 생성되는 속도가 증가하지만 H2O의 평형 농도에는 영향을 미치지 않습니다.




![[비디오] 넓은 일광에서 볼 수 있듯이 ISS 및 Atlantis 셔틀](/article/uploadfiles/202211/2022111014562385_S.jpg)