이온 성 화합물 명명에 대한 규칙은 화학적 공식을 서면 화합물 이름으로 변환하는 방법을 알려주는 간단한 지침 세트입니다. 다음은 이진 및 다 원소 화합물 이름의 예와 함께 규칙 목록입니다. 이 목록에는 당신이 알아야 할 드문 규칙과 예외가 포함되어 있습니다.
이온 성 화합물 명명에 대한 규칙
- 먼저, 질량과 전하에 대한 화학 공식의 균형을 유지하십시오. 이온 성 화합물은 전기적으로 중립적이다. 다시 말해, 양이온의 긍정적 인 전하는 음이온의 음의 전하와 정확히 균형을 이룹니다.
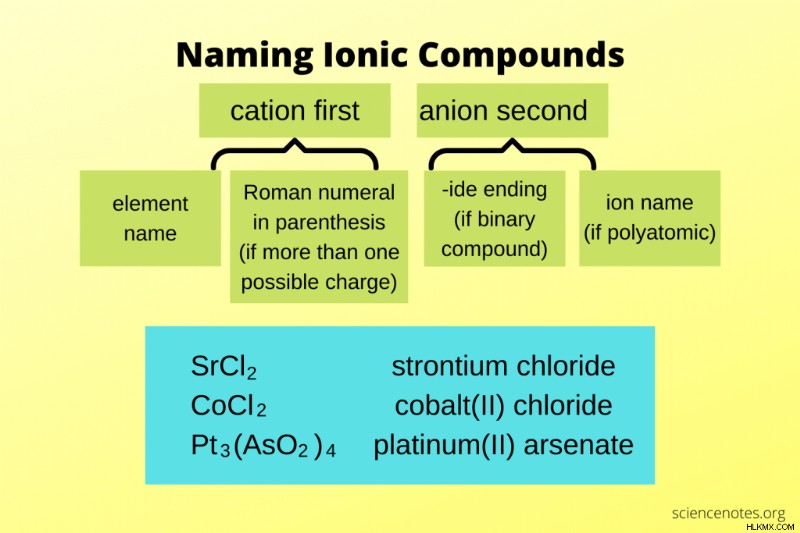
- 먼저 양이온의 요소 이름을 작성하십시오. 이것은 거의 항상 금속입니다. 한 가지 중요한 예외는 암모늄 양이온 (NH <서브> 4 입니다 ), 이것은 비금속으로 구성된 다 원자 양이온입니다. 그것은 염화 암모늄과 같은 이온 성 화합물을 형성한다 (NH <서브> 4 cl).
- 양이온 요소가 하나 이상의 가능한 산화 상태 (전하)를 갖는 경우, 적절한 로마 숫자를 포함하는 괄호로 요소 이름을 따르십시오. 요소 이름과 괄호 사이에는 공간이 없습니다. 이것이 적용되는 요소는 란타나이드 및 액티 나이드를 포함한 일부 전이 금속입니다. 예를 들어, 철 양이온은 철 (II) 또는 철 (III)입니다. 그룹 1 (알칼리 금속) 및 그룹 2 (알칼리성 지구 금속)의 금속은 항상 로마 숫자가없는 요소 이름으로 이동합니다.
- 공유 화합물 이름과 달리 양이온의 원자 수를 나타내는 접두사는 없습니다. 따라서 Hg 2 cl 2 수은 (II)은 클로라이드가 아니며 이량기 (II)이 염화물. 상대 구성을 표시하는 경우는 예외입니다. 그래서, k 2 mgcl 4 테트라 클로라이드 마그네슘 디포 사움은 kmgcl
3 와 구별됩니다 트리클로라이드 마그네슘 칼륨입니다. - 공식에 여러 금속 원자가있는 경우, 공식 및 이름은 요소를 알파벳 순서로 나열합니다. 때때로이 순서는 공식과 이름에 대해 다릅니다. 따라서 kmgcl 3 트리클로 라이드가 아닌 트리클로 라이드 마그네슘 트리클로라이드입니다.
- 음이온 이름은 양이온을 따릅니다. 공간은 이온 성 화합물 이름의 두 부분을 분리합니다. 화합물이 이진 화합물이거나 음이온이 단일 유형의 원자 인 경우, 음이온 이름은 요소 이름과 -ide 엔딩의 조합입니다. 예를 들어, AGCL은 염화는 은색이라는 이름을 가지고 있습니다.
- 음이온이 여러 유형의 원자로 구성된 경우 다 원자 이름을 사용하십시오.
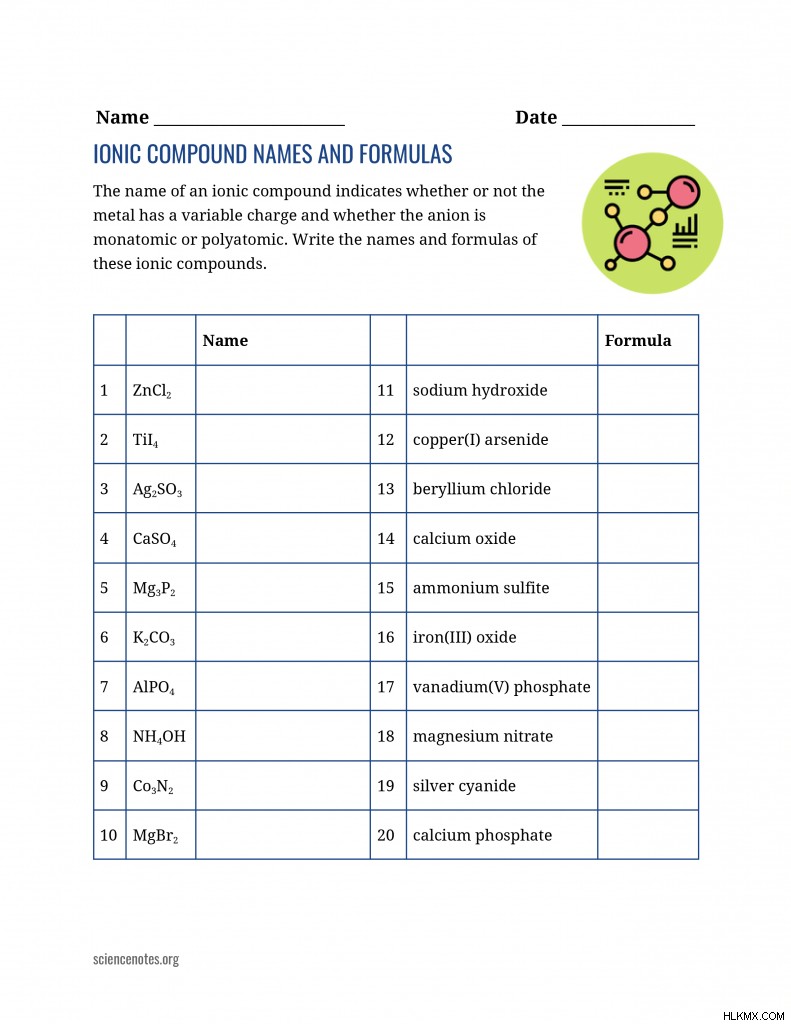
이온 성 화합물 이름 및 공식의 예
이진 화학 공식과 이름의 예는 다음과 같습니다.
| formula | 체계적인 이름 |
|---|---|
| srcl 2 | strontium chloride |
| cucl | 구리 (i) 클로라이드 |
| cucl 2 | 구리 (ii) 클로라이드 |
| mg (OH) | magnesium hydroxide |
| pt 3 (aso 2 ) | platinum (ii) arsenate |