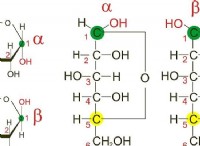
$$ \ pi =mrt $$
어디:
- \ (\ pi \)는 대기의 삼투압입니다 (ATM)
-M은 리터당 몰 (mol/l)의 용액의 콜라이트입니다.
-R은 이상적인 가스 상수입니다 (0.08206 L atm/mol k)
-t는 켈빈의 절대 온도입니다 (k)
우리는이 방정식을 사용하여 300k에서 삼투압 8.95 atm의 삼투압을 달성하는 데 필요한 수 크로스 용액의 몰토리성을 계산할 수 있습니다.
$$ m =\ frac {\ pi} {rt} =\ frac {8.95 atm} {(0.08206 l atm/mol k) (300 K)} $$
$$ M =0.375 mol/l $$
그런 다음 472 ml의 0.375 mol/L 용액을 만드는 데 필요한 자당의 질량을 계산해야합니다.
$$ mass =moles \ 시간 몰 질량 $$
자당의 몰 질량은 342.3 g/mol입니다.
$$ mass =0.375 mol/l \ times 472 ml \ times \ frac {1 l} {1000 ml} \ times 342.3 g/mol $$
$$ mass =59.8 g $$
따라서, 59.8 g의 자당은 472 ml의 물과 결합되어 300K에서 삼투압이 8.95 atm의 용액을 만들어야한다.