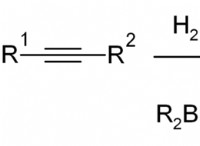산은 물에 용해 될 때 H+ 이온을 기증하여 용액의 농도가 증가합니다. H+ 이온 농도의 이러한 증가는 pH를 낮은 값으로 이동시켜 용액을보다 산성으로 만듭니다. pH 변화의 정도는 산의 강도와 그것이 첨가되는 농도에 의존한다. 강산은 물에 완전히 분리되어 다수의 H+ 이온을 방출하고 결과적으로 pH를 더 크게 감소시킨다. 반면에, 약산은 부분적으로 분리되어 H+ 이온을 적게 방출하고 pH의 더 작은 변화를 유발한다.
pH와 H+ 이온 농도의 관계는 로그입니다. 이것은 pH의 작은 변화가 H+ 이온 농도의 유의 한 변화에 해당한다는 것을 의미한다. 예를 들어, 7 내지 6으로 pH의 감소는 H+ 이온 농도의 10 배 증가를 나타낸다. 유사하게, 7 내지 8 로의 pH의 증가는 H+ 이온 농도의 10 배 감소를 나타낸다.