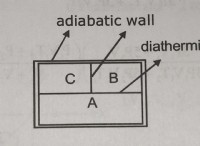
강산/염기 :
* 완전히 이온화 용액에서, 그들은 모든 수소 이온 (H+) 또는 수산화 이온 (OH-)을 용액에 기증한다는 것을 의미한다.
* 예 :
* 강산 : HCL (염산), HNO3 (질산), H2SO4 (황산)
* 강한베이스 : NaOH (수산화 나트륨), KOH (수산화 칼륨), liOH (리튬 수산화물)
약산/염기 :
* 부분적으로 이온화 용액에서, 그들은 수소 이온 또는 수산화물 이온의 일부만 기부한다는 것을 의미한다.
* 평형 에 존재합니다 그들의 이온화 및 비 이온 형태로.
* 예 :
* 약산 : CH3COOH (아세트산), H2CO3 (탄산), HF (히드로 플루오 산)
* 약한베이스 : NH3 (암모니아), CH3NH2 (메틸 아민), NAHCO3 (중탄산 나트륨)
다음은 주요 차이점을 요약 한 표입니다.
| 기능 | 강산/염기 | 약산/염기 |
| --- | --- | --- |
| 이온화 | 완료 | 부분 |
| 평형 | 평형 없음 | 평형 |
| 용액의 pH | 매우 낮거나 (산성) 또는 매우 높음 (기본) | 약간 산성 또는 기본 |
| 이온화의 강도 | 높은 | 낮음 |
이 차이의 중요성 :
* 강산/염기 더 부식성 더 심한 화학 화상을 유발할 수 있습니다.
* 약산/염기 일반적으로 처리하기가 더 안전합니다 일상 생활에서 종종 사용됩니다.
* 약산/염기 버퍼링 혈액 pH와 같은 생물학적 시스템에서 중요한 역할을합니다.
키 테이크 아웃 : 강한 산/염기의 차이는 H+ 또는 옴을 기증하는 능력에 있습니다. 강산/염기는 완전히 수행되는 반면, 약산/염기는 부분적으로 만 그렇게합니다. 이 차이는 반응성, 안전성 및 용도에 영향을 미칩니다.