주요 차이 - 에탄올의 연소 대 산화 반응
에탄올은 분자식 c 2 를 갖는 알코올입니다. h 5 오. 에탄올의 화학적 공식은 ch 3 이다 ch 2 오. 에탄올은 연소 반응을 겪을 수 있기 때문에 연료로 사용됩니다. 또한 알데히드 형태와 카르 복실 산 형태를 형성하기 위해 산화 반응을 겪을 수있다. 에탄올의 연소와 산화 반응의 주요 차이점은 에탄올의 연소 반응이 항상 열과 빛을 생성하는 반면 에탄올의 산화 반응이 항상 열과 빛을 생성하지는 않는다는 것입니다.
주요 영역을 다루었습니다
1. 에탄올의 연소 반응은 무엇입니까
- 정의, 속성, 반응
2. 에탄올의 산화 반응은 무엇입니까
- 정의, 속성, 반응
3. 에탄올의 연소와 산화 반응의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :알데히드, 바이오 연료, 이산화탄소, 일산화탄소, 카르 복실 산, 연소 반응, 완전한 연소, 완전한 산화, 에탄올, 가솔린, 불완전한 연소, 불완전 산화, 산화 반응 
에탄올의 연소 반응은 무엇입니까
에탄올의 연소 반응은 에탄올이 불에 타면 발생하는 반응입니다. 에탄올은 연료로 사용될 수있는 가연성 액체입니다. 에탄올의 연소는 에너지로 열과 빛을 생성 할 수 있습니다. 따라서, 에탄올의 연소는 발열 반응이다. 분자 산소의 존재하에 에탄올이 타는 경우 (O 2 ), 그것은 두 개의 최종 제품을 형성합니다. 그것들은 이산화탄소입니다 (Co 2 ) 및 물 분자 (H 2 o).
에탄올의 연소는 푸른 색의 불꽃으로 표시됩니다. 에탄올의 연소는 에탄올과 산소의 조합을 포함하는 간단한 과정이다. 에탄올의 연소는 두 가지 방식으로 발생할 수 있습니다.
- 완전한 연소
- 불완전한 연소

그림 01 :푸른 불꽃은 에탄올의 완전한 연소를 나타냅니다.
완전한 연소는 co 2 를 초래합니다 및 H 2 O. 그러나 불완전한 연소는 일산화탄소 (CO) 또는 탄소 (C)를 생성물로 생산합니다. 불완전한 연소가 불충분 할 때 불완전한 연소가 발생합니다 (O 2 ).
에탄올의 완전한 연소
ch 3 ch 2 오 (l) + 3o 2 (g) → 2co 2 (g) + 3H 2 o (l)
에탄올의 불완전한 연소
ch 3 ch 2 오 (l) + 2o 2 (g) → 2co (g) + 3H 2 o (l)
ch 3 ch 2 오 (l) + o 2 (g) → c (s) + 3H 2 o (l)
불완전한 연소는 종종 일산화탄소 (CO) 가스와 탄소 (c) 먼지를 혼합하게 만듭니다.
에탄올 연소에 의해 생성 된 열은 차량 엔진의 피스톤을 구동하는 데 사용됩니다. 에탄올은 또한 로켓 연료로 사용될 수 있습니다. 또한, 에탄올은 식물 물질의 바이오 매스로부터 바이오 연료로 생산 될 수있다. 따라서 에탄올은 화석 연료보다 환경 친화적 특성을 보여줍니다.
에탄올은 휘발유에 좋은 첨가물입니다. 에탄올과 휘발유의 혼합은 대기 오염 물질의 일부 배출을 방지합니다. 그러나 불에 타면 에탄올은 오염 물질을 방출하는 불꽃을 생성합니다.
에탄올의 산화 반응은 무엇입니까
에탄올의 산화 반응은 에탄올이 산화제에 의해 산화 될 때 발생하는 화학 반응입니다. 에탄올의 산화는 첫 번째 생성물로 에탄날이라는 알데히드를 생성한다. 에탄 산으로 알려진 카르복실산 형태를 형성하기 위해 추가 산화를 겪을 수 있습니다.
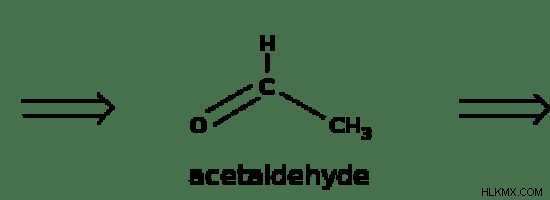
그림 2 :에탄올의 산화
그러나 에탄올의 산화는 촉매의 존재 하에서 발생할 수 있습니다. 이 촉매는 산화 반응의 활성화 에너지를 감소시키는 데 사용된다. 활성화 에너지가 높으면 반응이 시작되지 않습니다. 산화는 두 단계에서 발생할 수 있습니다 :
- 완전한 산화
- 불완전한 산화
에탄올의 완전한 산화는 에탄 산을 최종 제품으로 형성합니다. 에탄올의 불완전한 산화는 최종 생성물로서 에탄 날을 형성한다. 두 산화는 물 분자를 생성 할 것이다 (H 2 o) 부산물로서.
에탄올의 완전한 산화
에탄올 +산소 → 에탄 날 +물 → 에탄 산 +물
ch 3 ch 2 오 (l) + [O] → Ch 3 Cho (l) +h 2 o (l) → ch 3 cooh (l) +h 2 o (l)
에탄올의 완전한 산화는 반응이 끝날 때 에탄 산을 초래합니다. 그러나 에탄올 산화는 먼저 에탄 날을 형성하고 에탄날은 에탄 산으로 추가로 산화됩니다.
에탄올의 불완전한 산화
에탄올 + 산소 → 에탄 날 + 물
ch 3 ch 2 오 (l) + [O] → Ch 3 Cho (l) +h 2 o (l)
위의 방정식에서 [o]는 산화제에서 나오는 원자 산소를 나타냅니다. 예를 들어, 나트륨 디크로 메이트 (Na 2 를 고려해 봅시다 cr 2 o 7 )는 황산과 함께 산화제로 사용되었다 (H 2 . 그래서
ch 3 ch 2 오 (l) + na 2 cr 2 o 7 (aq) + h 2 So 4 (aq) → ch 3 Cho (l) + 2Nacro 4 (aq) + 2H 2 o (l)
에탄올의 산화는 반응을 완료하기 위해 촉매 또는 산화제가 필요합니다. 그러나, 에탄올의 산화는 에너지 형태로서 열이나 빛을 생성하지 않습니다. 에탄올의 산화의 또 다른 방법은 촉매를 통한 것입니다. 은 촉매는 그러한 촉매이다. 에탄올은 에탄올 증기의 혼합물을 전달하여 500C에서은 촉매에 공기를 통과시켜 산화 될 수있다. 이것은 물과 함께 제품으로서의 에탄 날을 초래합니다 (h 2 o).
에탄올의 연소와 산화 반응의 차이
정의
에탄올의 연소 반응 : 에탄올의 연소 반응은 에탄올이 태울 때 발생하는 반응입니다.
에탄올의 산화 반응 : 에탄올의 산화 반응은 에탄올이 산화제에 의해 산화 될 때 발생하는 화학 반응이다.
산화제
에탄올의 연소 반응 : 에탄올의 연소 반응은 산화제를 필요로하지 않습니다.
에탄올의 산화 반응 : 에탄올의 산화 반응에는 산화제의 존재가 필요합니다.
촉매
에탄올의 연소 반응 : 에탄올의 연소 반응에는 촉매가 필요하지 않습니다.
에탄올의 산화 반응 : 에탄올의 산화 반응은 촉매의 존재 하에서 발생할 수있다.
최종 제품
에탄올의 연소 반응 : 에탄올의 산화 반응의 최종 생성물은 Co
에탄올의 산화 반응 : 에탄올의 연소 반응의 최종 생성물은 H 2 와 함께 에탄 날 또는 에탄 산일 수 있습니다. o.
에너지 형태
에탄올의 연소 반응 : 에탄올의 연소 반응은 열과 빛을 생성 할 수 있습니다.
에탄올의 산화 반응 : 에탄올의 산화 반응은 열과 빛을 생성 할 수 없습니다.
결론
연소는 또한 연소의 최종 생성물이 항상 산화 된 종이기 때문에 산화 반응입니다. 또한, 연소는 산소와 출발 물질의 조합을 포함한다. 이것은 또한 연소가 산화 반응임을 나타냅니다. 이 두 현상 사이에는 유사점이 있지만, 에탄올의 연소와 산화 반응의 차이를 구별 할 수있는 뚜렷한 특성이 있습니다.