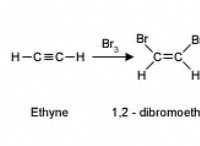
* 붕소의 전자 결핍 : 붕소에는 3 개의 원자가 전자가 있으며 옥셋을 완성하는 데 4 개가 필요합니다.
* 수소 고독한 전자 : 각각의 수소 원자는 결합에 기여하기 위해 하나의 전자를 갖는다.
* 전자 공유 : 붕소는 3 개의 수소 원자와 3 개의 전자를 공유하여 3 개의 B-H 결합을 형성합니다. 그러나, 기존의 2- 전자 공유 결합을 형성하기에 충분한 전자가 없다.
* 3- 센터 2- 전자 결합 : 이를 극복하기 위해, 붕소 원자는 3- 센터 2- 전자 결합이라고하는 특수 유형의 결합을 형성한다. 이러한 유형의 결합에서, 두 전자는 3 개의 원자 사이에서 공유된다.
단순화 된 설명 :
각 모서리에 수소 원자가있는 삼각형의 중앙에있는 붕소 원자를 상상해보십시오. 두 전자는 3 개의 원자들 사이에서 동일하게 공유되어 전자 밀도의 "바나나 모양의"구름을 만듭니다.
중요한 참고 : Borane (BH₃)은 반응성이 높으며 주로 이량 체, 디보 레인 (b₂h₆)으로 존재합니다. Diborane은 또한 3- 센터 2- 전자 결합을 특징으로하지만 그 구조는 더 복잡합니다.