할로겐화는 하나 이상의 수소 원자가 할로겐 그룹으로 대체되는 화학 반응이다. 우리가 할로겐 화합물의 반응성 순서를 살펴보면, 불소가 다른 모든 것보다 더 반응하는 불소> 염소> 브롬> 요오드로 발견됩니다. 동시에, 더 공격적이기 때문에 유기 물질과의 더 많은 반응에 참여합니다. 동시에, 그것은 또한 유기 질로겐을 가장 안정적으로 만드는 데 도움이됩니다. 불소 원자를 반응하게한다면 분리하기가 매우 어려울 수 있습니다.
마찬가지로 요오드가 유기 분자와 반응 해야하는 요오드 요오드 유기농을 만드는 것은 매우 어렵다. 그러나 반응 후 요오드를 쉽게 제거 할 수 있습니다. 이와 함께 우리는 또한 할로겐 반응 동안 구동력으로 작용하는 할로겐 원자의 전기 음성 성을 보게됩니다. 이 동안 분자의 본질은 또한 반응을 완료하는 데 중요한 역할을합니다. 포화 탄화수소 및 불포화 유기 할로겐화 반응이 발생하는 기질에 따라 여러 가지 유형의 할로겐화가 있습니다.
C6H6 + CL2 → C6H5CL + HCL
할로겐 반응이 중요한 이유는 무엇입니까?
화학적 합성은 할로겐 반응에 매우 중요합니다. 할로겐 반응을 통해 생성 된 생성물은 많은 곳에서 사용되며, 제약, 폴리머 및 플라스틱, 냉매, 연료 첨가제, 소방제, 농산물은 불소와 같은 주요 요소가 의약품과 같은 주요 지역에서 사용되는 주요 요소입니다. 또한 유기 브로마이드 및 유기 분야와 같은 화합물의 생산에 중요한 역할을합니다.
기질로서, 화학은 많은 분야에서 유용한 것으로 입증되어 기능적 그룹을 개선하고 복잡한 화학 반응의 기초를 제공하는 데 도움이된다. 이 알코올은 반응 중에 가수 분해되는 데 도움이되며, 여기서 C -Cl 또는 C -BR 결합을 형성하는 데 도움이됩니다. 케톤, 알데히드 및 산을 형성하는 데 도움이되는 산화 반응에 유용합니다.
이중 결합이 형성되는 제거 반응에도 필수적입니다. 화학 반응 동안 유기 화합물의 브로마 화는 종종 그리 라드 시약을 형성하는 데 도움이됩니다. 동시에, 그것은 또한 알킬 할라이드가 시약으로 사용되는 프리델 크래프트 반응 동안 주로 필요한 고리의 알킬화에 도움이된다. 또한 플루오로 에틸렌을 클로로 디 플루오로 메탄으로 전환시키는 데 중요한 역할을합니다.
할로겐화 반응의 유형
할로겐화 반응은 유기적으로나 무기 적으로 수행 될 수 있으며, 여기서 기질이 주된 기초를 제공하며, 여기서 할로겐화 방법이 설명되며, 이는 다음과 같습니다.
- 포화 탄화수소가있는 자유 라디칼 시스템
- 불포화 생물처럼
- 전자 유전 적 치환
자유 라디칼 할로겐화 또는 할로겐 치환- 포화 탄화수소는 주로 수소 원자를 사용하며, 여기서 수소 원자는 반응 동안 할로겐으로 대체됩니다. 여기서 C -H 결합의 상대적 약점은 반응에서 관찰되며,이 반응에서 알칸의 할로겐 레지오 화학이 결정됩니다. 이 동안, 반응은 알켄과 함께 수행되어 알킬 할로이드를 생성하는데, 여기서 열은 주요 기여자이다. 이 반응의 주요 사용은 산업에서 염소화 메탄의 생산에 있습니다.
CH4 + CL2 → CH3CL + HCL
할로겐 첨가 반응- 불포화 탄소는이 반응의 주요 부분이며, 여기서 알켄과 알킨스의 반응이 보입니다. 여기서 할로늄 이온은 반응에서 생성물 형성에 중요한 역할을하며, 여기서 할로겐은 알칸과 반응한다. 여기서 우리는 염소가 에틸렌과 반응하는 것을 볼 수 있습니다.
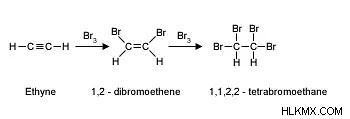
할로겐 치환 -이 반응은 주로 포화 탄화수소로 발생하며, 여기서 할로겐 원자는 반응 동안 수소 원자를 대체합니다. 또한 여기에 존재하는 자유 라디칼 할로겐은 일반적으로 탄화수소의 처리에 사용되며, 할로겐 포화 탄화수소와 함께 보이를 볼 수 있으며, 이는 알칸이 할로겐과의 반응 동안 C -H 결합을 형성 할 수 있습니다.
.여기에 주어진 예에서 우리는 한 가지를 발견 할 것입니다. 우리는 알칸과 반응 할 때 알킬 할라이드를 생성하지만,이 반응에서 열의 영향이 가장 눈에 띄지 만
.
ch3ch3 + cl2 → ch3ch2cl + hcl
CH4 + BR2 → CH3BR + HBR
여기서 우리는 루이스 산 (FECL3 또는 ALCL3)의 존재 하에서 다양한 반응을 볼 수 있으며, 주요 예는 치환 과정 또는 전자 성 할로겐화이다.
c6h5-h + cl2 → c6h5-cl + hcl
주로 방향족 할로겐 화합물을 사용하는 전자 유전 적 치환 반응- 전자 성 치환 과정, 브롬 및 염소가 주요 참가자로 참여합니다. 루이스 산은이 반응을 수행하는 데 사용됩니다.
2fe + 3cl2 → 2fecl3
2fe + 3br2 → 2febr3
예
할로겐의 반응성에 따라 F2> CL2> BR2> I2는 다음과 같이 관련 예를 들어 설명 할 수 있습니다.
염소와의 반응- 염소와 벤젠의 상호 작용은 일반적으로 철 또는 염화 알루미늄의 존재하에 수행되는 클로로 벤젠을 생성합니다. 염소화는 산소의 존재에 의해 상당히 느려집니다.
c6h6 + cl2 → c6h5-cl + hcl
불소와의 반응 - 불소와 벤젠의 상호 작용은 플루오로 벤젠을 생성하며, 이는 일반적으로 철 또는 염화 알루미늄의 존재하에 수행됩니다.
C6H5 -NO2 + F2 → C6H4 - F- NH2
결론
할로겐 반응은 주로 합성 화학에서 매우 중요하며, 폴리머 및 플라스틱, 냉매, 소방제, 연료 첨가제, 농산물 등과 같은 산업에서 큰 지원을 제공합니다. 또한 중합체 반응의 주요 기여자입니다. PV를 만들거나 디클로로 에탄 생산에도 필요합니다.