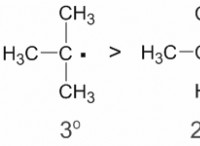
* 소금 (NaCl) : 소금은 이온 성 화합물입니다. 물에 용해 될 때, 양으로 하전 된 나트륨 이온 (Na+) 및 음으로 하전 된 클로라이드 이온 (Cl-)으로 분리됩니다. 이 유리 이온은 전류를 운반 할 수있어 용액을 전도시킬 수 있습니다.
* 설탕 (C12H22O11) : 설탕은 공유 화합물입니다. 물에 용해되면 이온으로 분해되지 않습니다. 대신, 그것은 중성 인 설탕 분자를 형성합니다. 이 분자들은 전류를 운반 할 수 없으므로 설탕 용액을 비전도로 만듭니다.
실험 :
1. 재료 : 배터리, 전구 및 전구에 연결된 2 개의 전선이있는 간단한 회로가 필요합니다. 또한 두 개의 비이커, 소금, 설탕 및 증류수가 필요합니다.
2. 절차 :
* 제어 : 전선을 증류수에 넣으십시오. 전구가 밝아서는 안됩니다. 증류수는 이온이 거의 없으며 도체가 열악합니다.
* 소금 : 물에 약간의 소금을 녹입니다. 전선을 소금 용액에 넣습니다. 전구가 밝아 야합니다. 소금 용액의 이온은 전류를 운반합니다.
* 설탕 : 설탕을 물에 녹입니다. 와이어를 설탕 용액에 넣으십시오. 전구가 밝아서는 안됩니다. 설탕 용액에는 전류를 운반하기위한 유리 이온이 부족합니다.
결론 : 전기를 전도하는 솔루션의 능력은 용해 된 이온이 포함되어 있는지에 대한 신뢰할 수있는 지표입니다. 소금 솔루션은 전기를 전환하는 반면 설탕 용액은 그렇지 않습니다.