주요 차이 - 공유 결합 대 좌표 본드
화학적 결합은 전자 교환을 통한 두 원자의 부착입니다. 이것은 전자 공유 또는 전자를 완전히 제거함으로써 이루어질 수 있습니다. 화학적 결합에는 항상 반대편 스핀이있는 한 쌍의 전자가 있습니다. 이 전자 쌍은 본드 쌍이라고합니다. 공유 결합 및 좌표 결합은 두 원자 사이에 전자를 공유하여 형성되는 화학적 결합이다. 두 원자가 전자를 공유 할 때 공유 결합이 형성된다. 그러나 하나의 원자가 여분의 전자 쌍 중 하나를 다른 원자에 기부 할 때 배위 결합이 형성된다. 그러나, 결합이 형성된 후, 공유 결합과 좌표 결합은 동일하게 보인다. 공유 결합과 좌표 결합의 주요 차이점은 공유 결합의 두 원자가 결합의 형성에 기여하는 반면, 배위 결합에서 하나의 원자만이 결합의 형성에 기여한다는 것이다.
주요 영역을 다루었습니다
1. 공유 결합
- 정의, 형성, 예
2. 좌표 본드
- 정의, 형성, 예
3. 공유 및 좌표 결합의 유사점
- 일반적인 기능의 개요
4. 공유 및 좌표 결합의 차이점
- 주요 차이점 비교
주요 용어 :본드 쌍, 배위 결합, 배위 화합물, 공유 결합, 고독한 쌍, 밸런스

공유 본드
공유 결합은 두 원자가 서로 짝을 이루지 않은 전자를 공유 할 때 형성되는 화학 결합의 한 유형입니다. 동일한 요소의 두 원자 또는 다른 원소 사이에 공유 결합이 형성 될 수 있습니다. 대부분의 경우, 이러한 공유 결합은 비금속 사이에서 발견됩니다. 두 원자는 이들 원자의 전기성이 거의 비슷할 때 전자를 공유 할 가능성이 더 높다.
원자는 가장 바깥 쪽 궤도에 짝을 이루지 않은 전자가있을 때 전자를 공유하는 경향이 있습니다. 때때로, 원자는 전자를 공유하여 안정성을 나타내는 옥트 규칙을 준수합니다. 그러나,이 전자 공유는 다른 조합에서 원자로 구성된 새로운 화합물의 형성을 초래한다. 특정 원자의 원자가에 따르면, 그것이 형성 할 수있는 공유 결합의 수는 다를 수 있습니다.
공유 본드는 시그마 본드 또는 PI 결합 일 수 있습니다. 시그마 본드는 단일 결합으로, 하나의 전자 쌍으로 구성됩니다. 이중 채권은 하나의 시그마 본드와 하나의 PI 결합으로 구성됩니다. 두 결합 모두 공유 결합입니다.
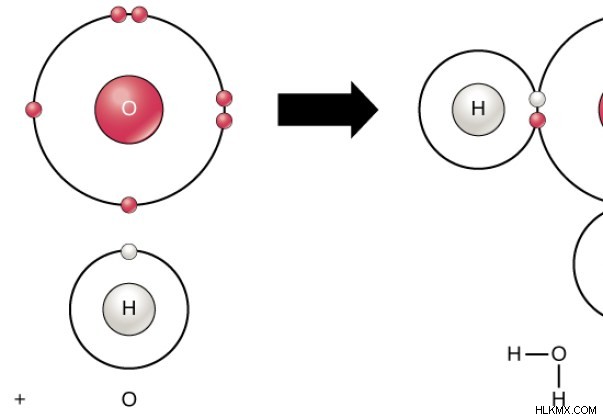
그림 1 :h 2 의 구조 o 분자
공유 결합을 형성하기 위해 두 원자는 동일한 양으로 기여해야합니다. 따라서, 각 원자로부터의 하나의 전자는 단일 결합을 형성하기 위해 참여해야한다. 이중 결합의 형성을 위해, 각 원자로부터의 2 개의 전자가 기증된다.
공유 결합은 각 원자의 전기 음성에 따라 극성 또는 비극성 결합 일 수 있습니다. 두 원자 사이의 전기 음성의 차이가 매우 낮거나 (0.4 미만) 0이면 비극성 공유 결합을 형성합니다. 두 원자의 전기 음성의 차이가 더 높으면 (0.4-1.7), 그것은 매우 극성 공유 결합입니다.
.좌표 본드
좌표 결합은 하나의 원자에 의해 다른 원자에 대한 고독한 전자 쌍의 기증으로 인해 형성되는 화학 결합의 유형입니다. 여기서, 고독한 전자 쌍은 두 개의 원자에 의해 공유된다. 이것은 전자가 풍부한 원자와 전자가 부족한 원자 사이에서 발생합니다. 전자가 풍부한 원자는 전자 결핍 원자에 한 쌍의 전자를 기증합니다. 그러나 좌표 결합이 형성된 후, 공유 결합과 동일하게 보입니다.
.좌표 결합을 형성하기 위해 전자 결핍 종은 들어오는 전자 쌍에 대한 빈 궤도가 있어야합니다. 예를 들어, bf 3 에서 분자, 붕소 (b)는 빈 p 궤도를 갖는다. B의 전자 구성은 옥켓 규칙에 순종하지 않기 때문에, NH 3 와 같은 전자가 풍부한 종과의 좌표 결합을 형성합니다. . 그곳에서, 질소 원자에는 bf 3 의 b 원자에 기증 될 수있는 고독한 전자 쌍이 있습니다. . 이 좌표 결합이 형성된 후, 전체 분자의 모든 결합은 비슷해 보입니다.

그림 2 :nh 3 사이의 결합 좌표 및 bf 3
금속 이온은 리간드라고하는 전자가 풍부한 종과 좌표 결합을 형성 할 수 있습니다. 금속 이온은 양으로 하전 된 원자이기 때문에, 리간드는 전자 쌍을 금속 원자에 기증 할 수있다. 대부분의 금속 원자에는 빈 D 궤도가 있기 때문에, 들어오는 전자 쌍은 빈 D 궤도에 통합 될 수있다. 이들 금속-리간드 복합체를 조정 복합체라고한다.
공유 및 좌표 결합 사이의 유사성
- 공유 및 좌표 결합이 형성된 후 두 유형의 결합이 동일하게 보입니다.
- 두 유형의 채권은 각 결합 당 하나의 전자 쌍으로 구성됩니다.
- 두 유형의 결합은 두 원자를 함께 부착시킵니다.
공유 및 좌표 결합의 차이
정의
공유 본드 : 공유 결합은 두 개의 원자가 서로 짝을 이루지 않은 전자를 공유 할 때 형성되는 화학적 결합 유형입니다.
조정 : 좌표 결합은 하나의 원자에 의해 다른 원자에 대한 고독한 전자 쌍의 기증으로 인해 형성되는 화학적 결합의 한 유형입니다.
.전자 기증
공유 채권 : 2 개의 원자는 결합 형성을 위해 동일한 수의 전자를 기증합니다.
좌표 채권 : 단 하나의 원자 만 결합 형성을 위해 한 쌍의 전자를 기증합니다.
짝을 이루지 않은 전자의 존재
공유 채권 : 공유 결합을 형성하려면 짝을 이루지 않은 전자가 있어야합니다.
좌표 채권 : 좌표 결합을 형성하기 위해서는 짝을 이루지 않은 전자가 없어야합니다.
빈 궤도의 존재
공유 채권 : 공유 결합을 형성하기 위해 빈 궤도가 필요하지 않습니다.
조정 : 좌표 결합을 형성하기 위해 빈 궤도는 전자 결핍 종에 존재해야합니다.
고독한 쌍의 존재
공유 채권 : 공유 결합을 형성하기 위해서는 고독한 전자 쌍이 필요하지 않습니다.
좌표 채권 : 좌표 결합을 형성하기 위해 두 원자 중 하나에 적어도 하나의 고독한 전자 쌍이 존재해야합니다.
결합의 극성
공유 본드 : 공유 결합은 두 원자의 전기성의 차이에 따라 극성 또는 비극성 일 수 있습니다.
좌표 채권 : 좌표 본드는 극지 결합입니다.
결론
공유 결합과 좌표 결합은 화학 결합의 유형입니다. 그들은 화합물을 형성하기 위해 원자를 함께 유지하는 데 도움이됩니다. 이들 결합의 형성 후, 공유 결합 및 좌표 결합은 동일하게 보인다. 그러나 그들은 동일하지 않습니다. 공유 결합과 좌표 결합 사이에는 뚜렷한 차이가 있습니다. 공유 결합에서, 두 원자는 결합의 형성에 관여하는 반면, 조정 결합에서는 하나의 원자만이 결합의 형성에 관여한다.