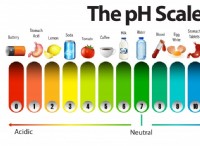
개념 이해
* stp (표준 온도 및 압력) : 이것은 특정 조건 세트를 나타냅니다 :0 ° C (273.15 k) 및 1 ATM 압력.
* stp :에서 가스의 몰 부피 STP에서 이상적인 가스의 1 몰은 22.4 L을 차지합니다.
계산
1. stp :에서 가스의 어금니 부피를 사용하십시오. 1 몰의 산소 가스는 STP에서 22.4 L을 차지하기 때문에 비율을 설정할 수 있습니다.
1 몰 / 22.4 L =X 몰 / 180 L
2. x (몰의 수) :
x =(1 몰 * 180 l) / 22.4 l
x ≈ 8.04 몰
답 : 대략 8.04 Moles가 있습니다 STP에서 180 L의 산소 가스.