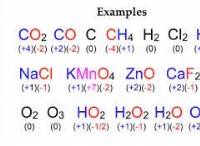
1. 분자 질량의 개념을 이해하십시오
* 분자 질량 : 분자 질량은 분자에서 모든 원자의 원자 질량의 합입니다. 원자 질량 단위 (AMU)로 표현됩니다.
* 원자 질량 단위 (AMU) : 하나의 AMU는 양성자 또는 중성자의 질량과 거의 같습니다.
2. 분자 질량을 계산하십시오
* 주기성 테이블을 사용하십시오 : 주기율표에는 각 요소의 원자 질량이 나와 있습니다.
* 첨자로 곱하십시오 : 분자의 화학적 공식을보십시오. 첨자는 분자에서 각 원소의 원자 수를 나타냅니다. 각 요소의 원자 질량에 첨자로 곱하십시오.
* 결과를 합산하십시오 : 분자의 모든 요소에 대한 결과를 추가하십시오.
예 :물 (HATER)
1. 원자 질량 :
* 수소 (H) :1.008 AMU
* 산소 (O) :15.999 AMU
2. 계산 :
* 2 수소 원자 * 1.008 AMU/ATOM =2.016 AMU
* 1 산소 원자 * 15.999 AMU/ATOM =15.999 AMU
* 총 분자 질량 =2.016 AMU + 15.999 AMU =18.015 AMU
3. 그램으로 변환
* Avogadro의 번호 : 물질의 한 몰에는 6.022 x 10²³ 분자가 있습니다.
* 몰 질량 : 몰 질량은 1 몰의 물질의 질량이며, 그램의 분자 질량과 수치 적으로 동일합니다.
* 계산 : 단일 분자의 질량을 찾기 위해 Avogadro의 수로 몰 질량 (그램)을 나누십시오.
예 :물 (HATER)
* 몰 질량 : 18.015 g/mol
* 하나의 물 분자의 질량 : (18.015 g/mol)/(6.022 x 10²³ 분자/mol) ≈ 2.992 x 10 ²³ g
키 포인트 : 단일 분자의 질량은 엄청나게 작으며 일반적으로 분자 당 그램 또는 AMU 단위로 발현됩니다.