핵심 개념
전자 친화력에 대한이 튜토리얼에서, 우리는 그 정의, 관련주기적인 테이블 트렌드 및 이에 영향을 미치는 요소를 다룰 것입니다.
다른 기사에서 다루는 주제
- 전기 음성 이온화 에너지
- 주기적 테이블 트렌드
- 격자 에너지
- 전자 궤도 및 궤도 형태
전자 친화력이란 무엇입니까?
화학자들은 전자 친화력이 전자가 기체 원자에 첨가 될 때 경험 된 KJ/몰의 단위로 측정 된 에너지의 변화로 정의한다. 이 과정은 음의 이온을 만듭니다. 이 과정은 전기 음성 성과 다릅니다.이 과정은 전자를 자체로 끌어들일 수있는 원자의 능력으로 정의합니다.
우리는 전자 친화력을 전자를 얻는 원자의 "우도"또는 "기회"에 비유하는 경향이 있습니다. 이온화 에너지의 반대이며, 기체 원자를 이온화하고 결과적으로 전자를 제거하는 데 필요한 에너지입니다. 본질적으로, 전자 친화도는 하나의 전자의 이득과 함께 한 에너지 변화와 하나의 전자를 잃는 에너지와 관련된 에너지 변화와 관련이있다. 이온화 에너지는 항상 양의 이온의 형성을 포함하고, 전자 친 화성 에너지는 음성 이온의 생성을 설명한다.
첫 번째 및 제 2 전자 친화도
전자 친화력에는 두 가지 유형의 전자 친화력이 있습니다. 첫 번째는 중성 원자 에 전자를 첨가하는 것입니다. . 이 발열 공정은 에너지를 방출하기 때문에, 제 1 전자 친화도는 음의 값이다.
두 번째는 음의 이온에 전자를 첨가하는 것과 관련이 있습니다 . 이 흡열 과정은 전자가 시스템에 추가 될 때 방출되는 것보다 더 많은 에너지가 필요합니다. 이것은 양의 제 2 전자 친화력 값을 초래한다.
정기 트렌드
기간 동안
주기율표에서 왼쪽에서 오른쪽으로 여행 할 때 전자 친화도는 더 긍정적이됩니다. 과학자들은이 패턴 이이 패턴을 더 오른쪽 원자의 핵에 더 가깝게 첨가 할 것이라고 생각합니다.
요소가 오른쪽으로 경향이 있기 때문에 추가 된 전자는 핵에 더 가깝게 앉아 있습니다. 이 전자는이 근접성의 결과로 핵에 더 강한 인력을 나타내며 전자 친화도의 발열 성질을 설명합니다.
.다운 그룹
우리가 그룹을 내려 가면서, 전자 친화도는 더 부정적이되어, 이는 과정이 더 흡열성이라는 것을 의미합니다. 이들 각각의 핵에 대한 전자 근접성은 또한이 현상에 영향을 미치지 만, 이전 경향과는 달리, 전자는 더 높은 에너지 수준으로 배치된다. 우리가 그룹을 여행 할 때, 원소는 핵에서 더 많은 전자를 포함하고 있으며,이 전자는 덜 단단히 결합됩니다.
느슨하게 결합 된 전자는 단단히 결합 된 대응 물에 비해 원자를 결합 할 때 많은 에너지를 방출하지 않습니다. 주기적인 표에서 낮은 요소는 여분의 전자를 첨가하면 에너지가 적어 전자 친화력의 감소 된 발열 특성을 제공합니다.
추세 요약
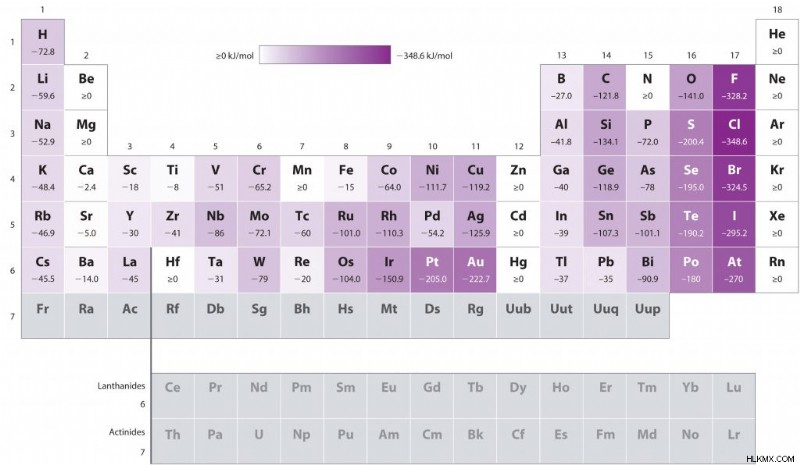
아래는 주기율표 전체에서 전자 친화력 경향의 시각적 표현입니다. 논의 된 바와 같이, 전자 친화도는 기간에 걸쳐 왼쪽에서 오른쪽으로 증가한다. 전자 친화력은 상단에서 하단 다운 그룹으로 감소합니다.
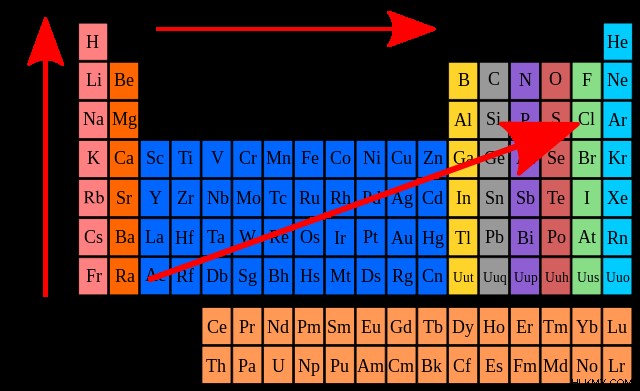
차폐 효과
원자가 전자가 전자 친화력 경향에 어떤 영향을 미치는지 고려해 봅시다. 전자 친화력이 감소함에 따라 주기성 테이블에서 그룹을 아래로 이동함에 따라 원자가 전자의 수가 증가합니다. 차폐 효과 을 고려하여이를 합리화 할 수 있습니다 . 이 규칙은 핵이 원자가 전자를 유치하는 동안 반발력은이 매력에 대항한다는 것을 인정합니다. 이 반발력은 핵과 외부 전자 사이에 위치한 내부 전자에 의해 생성됩니다.
우리가 각 그룹을 내려 가면 차폐 효과의 영향이 증가합니다. 외부 전자와 각각의 핵 사이의 인력이 감소하여 전자 친화력이 적은 요소를 생성합니다.
불소의 예외
불소는 그룹 전자 친 화성 경향에 관한 또 다른 경고를 나타냅니다. 우리가 부정적인 이온의 형성에 에너지 관여가 적은 에너지에 해당하는 첫 번째 전자 친화도는 일반적으로 그룹을 내려갈 때 감소하지만 불소 원자는이 패턴을 깨뜨립니다.
각 그룹의 상단에서의 위치를 감안할 때 불소는 비교적 높은 전자 친화력을 나타낼 것으로 예상됩니다. 불소의 매우 작은 원자 반경으로 인해 핵을 둘러싼 공간도 매우 작으므로 들어오는 전자와 불소 핵 사이의 인력이 증가하고 전자 친화력이 확장됩니다.
그러나, 우리는 들어오는 전자가 높은 수준의 반발에 의해 이미 영향을받는 붐비는 지역으로 들어갈 것이라는 점을 명심해야합니다. 우리가 이야기 한 바와 같이, 반발은 전자와 핵 사이의 인력을 감소시켜 전자 친화력을 줄입니다. 이러한 반발 효과는 불소 원자에서 강력하여 예상보다 작은 전자 친화도를 나타냅니다.
금속 대 비금속
일반적으로 금속은 전자 친화력이 낮고 비금속은 더 높습니다.
금속
금속은 양이온의 형성을 통해 안정적인 옥셋을 형성하기를 원합니다. 이것을 달성하기 위해, 그들은 원자가 전자를 포기하는 경향이 있습니다. 그들은 전자를 잃을 때 에너지를 흡수하여 낮고 흡열, 친화력에 기여합니다.
비금속
반대로, 비금속은 전자를 얻기 위해 전자를 얻는 것을 좋아합니다. 그들은 전자를 취할 때 에너지를 방출하여 더 높고 발열 전자 친화력을 생성합니다.
원자의 전자 친화력에 영향을 미치는 것은 무엇입니까?
다시 한번, 우리가 전자 친화력에 대해 이야기 할 때, 우리는 전자를 얻을 때 원자가 경험하는 에너지의 변화를 참조합니다. 이 과정은이 들어오는 전자와 관련된 원자의 핵 사이의 인력의 양을 반영합니다. 매력이 강할수록 더 많은 에너지가 방출되고 전자 친화력이 높아질 수 있습니다.
우리의 예에서 볼 수 있듯이 이러한 추세에 영향을 미치는 두 가지 주요 요인에는 원자 크기와 핵 전하가 포함됩니다. 더 큰 양전하를 보유하는 핵은 전자를 더 강하게 끌어 들여 더 큰 전자 친화력을 초래합니다. 반대로, 덜 긍정적 인 핵 전하는 더 작은 전자 친화력을 촉진합니다.
원자 크기와 관련하여, 작은 원자는 들어오는 전자를 포함하여 전자가 모일 공간이 적습니다. 결과적으로,이 여분의 전자는 더 큰 원자보다 핵에 더 가깝게 배치 될 것이다. 이것은이 들어오는 전자와 핵 사이의 인력이 증가한 결과로 작은 원자에 대한 더 큰 전자 친 화성 값을 초래한다. 반면에, 더 큰 원자는 전자가 들어오는 전자뿐만 아니라 전자와 공유 할 수있는 더 많은 공간을 제공하기 때문에 더 작은 전자 친화도를 나타내는 경향이있다.
그러나 우리는 반발과 차폐가 전자 친화력에 미치는 영향을 과소 평가해서는 안됩니다. 예를 들어, 작은 원자는 더 많은 인력과 더 큰 전자 친화력을 나타낼 수 있지만, 전자를 모을 공간이 부족하면 이들 입자들 사이에 반발이 증가합니다. 반발은 들어오는 전자와 핵 사이의 인력을 줄여서 전자 친화도를 낮추는 것을 용이하게한다. 차폐 효과는 유사하게 작용합니다.
우리는 각 요소의 특성에 따라 영향을 미치기 때문에 이러한 각 요소를 신중하게 고려해야합니다. 아래 질문을 조사하면이 분석의 예가 제공됩니다.
어떤 요소가 가장 낮은 전자 친화력을 갖는가?
수은은 원소들 사이에서 전자 친화력이 가장 낮습니다. 이 상태는 금속으로서의 묘사에 기인 할 수 있습니다. 금속은 일반적으로 전자를 잃을 가능성이 더 높으며 전자를 잃을 가능성이 높습니다. 머큐리는 비교적 큰 원자 반경을 가지고 있으며, 이는 또한 낮은 값에 기여합니다.
어떤 요소가 가장 높은 전자 친화력을 갖는가?
염소는 원소들 사이에서 전자 친화력이 가장 높습니다. 높은 친화력은 큰 원자 반경 또는 크기에 기인 할 수 있습니다. 염소의 가장 바깥 쪽 궤도는 3p이기 때문에 전자는 들어오는 전자와 공유 할 공간이 많습니다. 이것은 이들 입자들 사이의 반발을 매력에 대한 큰 크기의 부정적인 영향을 능가하는 정도를 최소화한다.
전자 친화력 차트