화학 방정식의 한계 :
화학 방정식은 화학 반응을 나타내는 강력한 도구이지만 특정 제한 사항이 있습니다.
1. 그들은 반응 메커니즘을 보여주지 않습니다 : 방정식은 반응과 관련된 중간 단계가 아니라 반응물과 제품 만 보여줍니다. 다른 반응이 동일한 반응물과 생성물을 가질 수 있지만 완전히 다른 메커니즘을 진행하기 때문에 이것은 오해의 소지가있을 수 있습니다.
2. 그들은 반응 조건을 나타내지 않습니다 : 화학 방정식은 일반적으로 반응이 발생하는 데 필요한 온도, 압력, 촉매 또는 용매를 지정하지 않습니다. 이로 인해 실험실 환경에서 반응이 실제로 어떻게 진행될 수 있는지 이해하기가 어려울 수 있습니다.
3. 반응 속도를 반영하지 않습니다 : 방정식은 반응이 얼마나 빨리 진행되는지 또는 실제로 실현 가능한지 알려주지 않습니다. 일부 반응은 매우 느리고 다른 반응은 즉시 발생합니다.
4. 그들은 부작용을 설명하지 않습니다 : 방정식은 종종 주요 반응을 나타내며 동시에 발생할 수있는 잠재적 인 부작용을 무시합니다. 이로 인해 불완전하거나 오해의 소지가있는 결과가 발생할 수 있습니다.
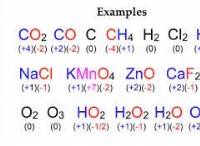
5. 그들은 반응물과 제품의 물리적 상태를 묘사하지 않습니다. 때때로 첨자 (S, L, G, AQ)로 표시되지만 방정식은 반응 중에 발생하는 물리적 상태 변화를 완전히 표현하지 않습니다.
6. 그들은 에너지 변화를 설명하지 않습니다 : 방정식은 반응이 발열 (열을 방출)인지 흡열 (열을 흡수)인지를 나타내지 않습니다.
이러한 제한을 극복 :
1. 반응 메커니즘 연구 : 반응의 상세한 과정을 이해하려면 분광법, 동역학 및 계산 화학과 같은 다양한 기술을 사용하여 연구 할 수있는 메커니즘을 탐구해야합니다.
2. 상세한 반응 조건 : 방정식 외에도 특정 온도, 압력, 촉매 및 용매 정보를 제공하면 반응의 타당성을 명확하게하고 재생산을 용이하게합니다.
3. 동역학 및 열역학 : 반응 속도와 열역학적 측면을 연구하면 반응의 타당성과 속도를 이해하는 데 도움이되며, 이는 실제 적용에 중요합니다.
4. 부작용 및 제품 분석 : 측면 제품을 포함한 반응 생성물의 신중한 분석 및 특성화는 전체 반응 과정의 완전한 그림을 얻는 데 도움이됩니다.
5. 고급 표현 : 다이어그램 및 기타 시각 보조제를 통해 물리적 상태, 에너지 변화 및 반응 조건에 대한 더 많은 정보를 통합하면보다 포괄적 인 표현을 제공 할 수 있습니다.
6. 계산 화학 : 정교한 소프트웨어 및 시뮬레이션 도구는 화학 반응을 모델링하여 메커니즘, 에너지 변화 및 실험적으로 쉽게 관찰 할 수없는 기타 요인에 대한 통찰력을 제공 할 수 있습니다.
결론 :
화학 방정식은 화학 반응의 단순화 된 표현입니다. 그들의 한계를 인식하고 추가 정보 및 도구를 통합하면 실제 반응의 복잡성을 이해하고보다 효과적이고 효율적인 합성 전략을 개발할 수 있습니다.