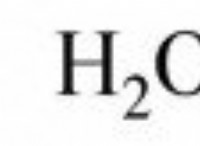그룹 1 (알칼리 금속) :+1
* 예 : 나트륨 (na,), 칼륨 (k⁺)
* 이유 : 알칼리 금속에는 하나의 원자가 전자 (가장 바깥 쪽 쉘에 전자)가 있습니다. 그들은이 전자를 쉽게 잃어 버려서 가장 바깥 쪽 쉘에서 안정적인 옥셋 (8 전자)을 달성하여 +1 전하를 형성합니다.
그룹 2 (알칼리성 지구 금속) :+2
* 예 : 칼슘 (ca²⁺), 마그네슘 (mg²⁺)
* 이유 : 알칼리성 지구 금속에는 2 개의 원자가 전자가 있습니다. 그들은 안정적인 옥틴을 달성하기 위해 둘 다 잃어 +2 충전을 초래합니다.
그룹 13 (붕소 그룹) :+3
* 예 : 알루미늄 (al³um)
* 이유 : 붕소 그룹 요소에는 3 개의 원자가 전자가 있습니다. 그들은 안정적인 옥셋을 달성하기 위해 이것들을 잃어 버리는 경향이 있으며, +3 전하를 형성합니다. 그러나이 그룹의 일부 요소는 다른 요금도 형성 할 수 있습니다.
그룹 14 (카본 그룹) :가변
* 예 : 탄소 (CAT, CAT), 실리콘 (SI⁴⁺, SI⁴⁻)
* 이유 : 이 그룹의 요소에는 4 개의 원자가 전자가 있습니다. 안정적인 옥셋을 달성하기 위해 전자를 얻거나 잃을 수있어 가변적으로 충전됩니다.
그룹 15 (질소 그룹) :-3
* 예 : 질소 (n³ n), 인 (p³⁻)
* 이유 : 이 그룹의 요소에는 5 개의 원자가 전자가 있습니다. 그들은 안정적인 옥셋을 달성하기 위해 3 개의 전자를 얻는 경향이있어 -3 전하가 발생합니다.
그룹 16 (산소 그룹) :-2
* 예 : 산소 (o² o), 황 (s²⁻)
* 이유 : 이 그룹의 요소에는 6 개의 원자가 전자가 있습니다. 그들은 안정적인 옥셋을 달성하기 위해 2 개의 전자를 얻는 경향이있어 -2 전하가 발생합니다.
그룹 17 (Halogens) :-1
* 예 : 염소 (CL⁻), 브로 민 (Brom)
* 이유 : 할로겐에는 7 개의 원자가 전자가 있습니다. 안정적인 옥셋을 달성하기 위해 하나의 전자를 얻어 -1 전하를 초래합니다.
그룹 18 (고귀한 가스) :보통 0
* 예 : 헬륨 (HE), 네온 (NE), 아르곤 (AR)
* 이유 : 고귀한 가스는 이미 전자의 외부 껍질 (안정적인 옥트)을 가지고 있으므로 이온을 거의 형성하지 않습니다.
전이 금속 :가변
* 예 : 철 (fe² fe, fe³⁺), 구리 (cu⁺, cu²⁺)
* 이유 : 전이 금속은 다양한 수의 원자가 전자를 가지며 다수의 전하를 갖는 이온을 형성하기 위해 다른 수의 전자를 잃을 수있다.
중요한 메모 :
* 예외 : 이러한 일반적인 추세에는 예외가 있습니다. 예를 들어, 납 (PB)은 +2 및 +4 이온을 모두 형성 할 수 있으며 일부 전이 금속은 예상치 못한 전하로 이온을 형성 할 수 있습니다.
* 다 원자 이온 : 많은 이온은 다 원자 이온으로 알려진 하나 이상의 원자로 구성됩니다. 그들은 특정한 전반적인 요금이 있습니다. 예로는 설페이트 (SOATER), 질산염 (NOI) 및 포스페이트 (POATANTER)가 있습니다.
이 설명이 도움이되기를 바랍니다!