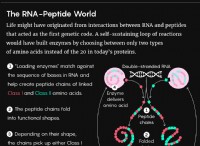
1. 분자식 방정식 :
* 이것은 반응을 쓰는 가장 일반적인 방법입니다. 반응물과 제품의 화학 공식을 사용합니다.
* 예 :
* 반응물 :h :+ o₂
* 제품 :h .o
* 반응 :h₂ + o₂ → h₂o (이것은 균형이 맞지 않습니다)
2. 순 이온 방정식 :
* 이것은 실제로 반응에 참여하는 종에 중점을 둡니다. 그것은 관중 이온 (존재하지만 변하지 않는 이온)을 생략합니다.
* 예 :
* 완전한 이온 방정식 :2H⁺ (aq) + 2Cl⁻ (aq) + ca²⁺ (aq) + 2oh⁻ (aq) → ca²⁺ (aq) + 2Cl⁻ (aq) + 2h₂o (l)
* 순 이온 방정식 :2H⁺ (aq) + 2oh⁻ (aq) → 2h₂o (l)
3. 단어 방정식 :
* 이것은 반응물과 제품의 이름을 사용합니다.
* 예 : 수소 가스는 산소 가스와 반응하여 물을 생산합니다.
4. 반응 체계 :
* 이것은 반응의 흐름을 보여주기 위해 화살표를 사용하여 반응의 단순화 된 표현입니다.
* 예 :
* A → B + C
* 반응물 A가 제품 B 및 C를 생산한다는 것을 보여줍니다.
5. 반응 메커니즘 :
* 반응이 진행되는 방법에 대한 단계별 설명입니다. 그들은 특정 화학 구조와 중간체를 사용합니다.
* 예 :
* 1 단계 :A + B → c
* 2 단계 :C + D → E
특정 화학 반응에 가장 적합한 속기는 컨텍스트와 전달 해야하는 정보에 따라 다릅니다.