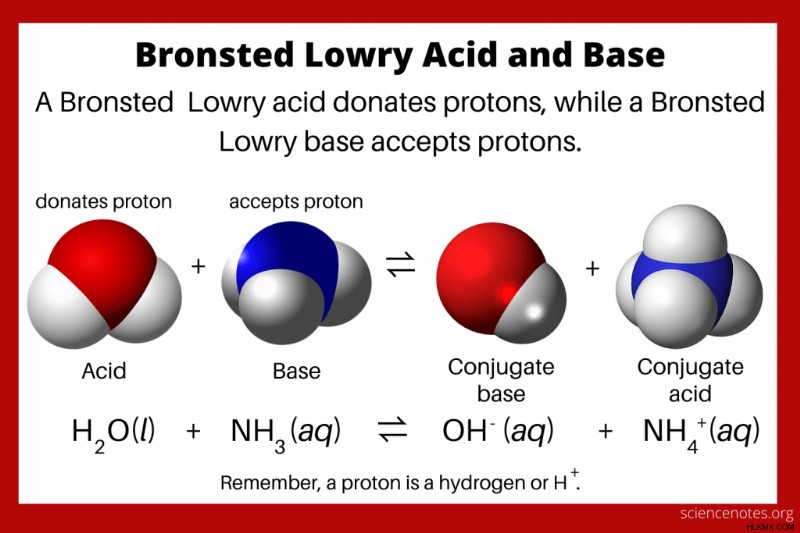
는 Lowry Acid and Base 이론을 청소했다. 산은 양성자 (수소 이온, H+)를 기증하는 반면, 염기는 양성자를 받아 들인다 고 말합니다. 반응은 산의 컨쥬 게이트 염기 및 염기의 컨쥬 게이트 산을 형성한다. 이론의 다른 이름은 brønsted – lowry 이론 입니다 또는 산 및 염기의 양성자 이론 . Johannes Nicolaus Brønsted와 Thomas Martin Lowry는 1923 년 이론을 Arrhenius Acid and Bases의 일반화로 독립적으로 설명했습니다.
- brønsted – lowry 이론 산을 양성자 공여체로 정의하고 기초를 양성자 수용체로 정의합니다.
- 양성자는 본질적으로 h 이온이므로 모든 청색 저리 산에는 수소가 들어 있습니다.
- 산과 염기는 컨쥬 게이트 쌍으로 존재합니다. 산이 양성자를 기증 할 때, 그것은 그의 컨쥬 게이트 염기를 형성한다. 베이스가 양성자를 수용하면 컨쥬 게이트 산을 형성합니다.
- 일부 화합물은 반응에 따라 산 또는 염기 역할을합니다. 산과 염기 둘 다인 화합물은 양서류입니다.
Bronsted Lowry Acids and Bases 정의
Bronsted Lowry 이론에 따르면 산은 양성자 공여자입니다. 양성자는 본질적으로 H 이온이기 때문에, 모든 기관지-로운 산은 수소를 함유한다. 베이스는 양성자 수용체입니다. 산이 양성자를 기증 할 때, 그것은 접합체베이스가된다. 염기가 양성자를 수용하면 접합체 산을 형성합니다. 양서류 화합물은 양성자를 기증하거나 받아 들일 수있는 종입니다.
예를 들어, 염산 (HCL)과 암모니아 (NH <서브> 3 사이의 반응을 고려하십시오. )는 암모늄 이온을 형성합니다 (NH <서브> 4 ) 및 클로라이드 이온 (Cl).
HCL (AQ) + NH 3 (AQ) → NH 4 (aq) + cl (aq)
이 반응에서, HCL은 NH <서브> 3 에 수소를 기증한다 . HCl은 Bronsted Lowry Acid 및 NH 3 입니다 Bronsted Lowry 기지입니다. HCL이 양성자를 기증 할 때, 그것은 그의 컨쥬 게이트베이스 인 Cl을 형성한다. nh 3 양성자를 받아들이고, 접합체 산, nh 4 를 형성합니다 . 따라서 반응에는 두 개의 컨쥬 게이트 쌍이 포함됩니다.
- HCl (산) 및 Cl (컨쥬 게이트베이스)
- nh 3 (베이스) 및 nh 4 (컨쥬 게이트 산)
강하고 약한 청동색 저리 산과 염기
산이나 염기는 강하거나 약합니다.
강산 또는 염기는 용매에서 이온에 완전히 분리되며, 이는 일반적으로 물입니다. 모든 강산은 모든 강한 산은 그의 컨쥬 게이트 염기로 전환되는 반면, 강한 염기는 모두 컨쥬 게이트 산으로 전환된다. 강산의 컨쥬 게이트 염기는 매우 약한 염기입니다. 강한 염기의 컨쥬 게이트 산은 매우 약한 산입니다. 강한 기관지 저리 산의 예로는 염산 (HCl), 질산 (HNO 3 가 포함됩니다. ), 황산 (H 2 그래서
약산 또는 염기는 불완전하게 분리되어, 약산 및 그의 접합체베이스 또는 약한 염기 및 그의 컨쥬 게이트 산이 모두 용액에 남아있는 평형 조건에 도달한다. 약한 기관지 저리 산의 예로는 인산 (H 3 가 포함됩니다. po 4 ), 아산산 (hno 2 ) 및 아세트산 (CH 3 COOH). 약한 염기의 예로는 암모니아 (NH <서브> 3 가 포함됩니다 ), 구리 수산화물 (Cu (OH) 2 ), 및 메틸 아민 (ch₃nh₂).
물은 수륙 양용이며 일부 반응에서 산으로 작용하고 다른 반응의 기초로 작용한다는 것을 기억하십시오. 물에 강산을 녹일 때 물은 기초 역할을합니다. 물에 강한베이스를 녹일 때 물은 산 역할을합니다.
예를 들면 :
HCL (aq) + H 2 o (l) → H 3 o (aq) + cl (aq)
컨쥬 게이트 쌍은 다음과 같습니다.
- Hcl (산) 및 Cl- (접합체베이스)
- h 2 O (베이스) 및 H 3 O (컨쥬 게이트 산)
naoh (s) + h 2 O (l) → Na (aq) + Oh (aq)
컨쥬 게이트 쌍은 다음과 같습니다.
- naoh (베이스) 및 Na (컨쥬 게이트 산)
- h 2 O (산) 및 OH (컨쥬 게이트베이스)

pH를 찾는 방법
산은 7 세 미만의 pH를 가지고 있고, 염기는 7 이상으로 pH를 가지고 있습니다. 값을 찾는 방법은 다음과 같습니다.
Arrhenius 산 및 기초와 비교
Bronsted Lowry 이론은 산과 염기의 Arrhenius 이론보다 덜 제한적입니다. 우선, 물 이외의 용매를 허용합니다. 또 다른 차이점은 산 및 염기의 정의 특성과 관련이 있습니다. Arrhenius 이론에 따르면, 산은 물에서 수소 이온 (H) 농도를 증가시키는 반면, 염기는 수산화물 이온 (OH) 농도를 증가시킨다. Bronsted Lowry 이론은 OH를 포함하지 않거나 적어도 물에 이온을 형성하지 않는 염기를 허용합니다. 예를 들어, 암모니아 (NH <서브> 3 )는 Arrhenius베이스입니다. 비록 OH가 포함되어 있지 않더라도 물에서 수산화 이온의 농도가 증가하기 때문입니다. 암모니아는 또한 Bronsted Lowry 기지입니다. 그러나, 메틸 아민 (ch₃nh₂)은 브론 스테드 로리베이스이지만 Arrhenius베이스는 아닙니다. 그것은 수산화물을 함유하거나 물에 이온 농도를 높이 지 않습니다.
대부분 Arrhenius와 Bronsted Lowry Acids 목록은 동일하지만 예외가 있습니다. 예를 들어, 디메틸 아민 [(ch 3 )
Gilbert Lewis는 Bronsted와 Lowry가 그들의 이론을 발표 한 같은 해에 Lewis Acids and Bases를 제안했습니다. 두 이론의 가장 큰 차이점은 Bronsted Lowry 이론이 양성자를 다루고 Lewis 이론은 전자에 중점을 둔다는 것입니다. 루이스 이론에 따르면, 산은 전자 쌍 수용체이고, 염기는 전자 쌍의 공여체이다. 두 이론 모두 컨쥬 게이트 산 및 염기가 포함됩니다.
모든 기관지 저리 산은 루이스 산이지만, 모든 루이스 산이 브론 스테드 저리 산은 아니다. 루이스 이론은 수소 원자를 함유하지 않는 산을 허용합니다. 예를 들어, bf 3 및 Alcl
참조
- Brönsted, J. N. (1923). “Einige bemerkungen über den begriff der säuren und basen”[산과 염기의 개념에 대한 일부 관찰]. recueil des travaux chimiques des pays-bas . 42 (8) :718–728. doi :10.1002/recl.19230420815
- 홀, 노리스 F. (1940 년 3 월). “산과 염기의 시스템”. 화학 교육 저널 . 17 (3) :124–128. doi :10.1021/ed017p124
- Lowry, T. M. (1923). “수소의 독창성”. 화학 산업 협회 저널 . 42 (3) :43–47. doi :10.1002/jctb.5000420302
- 마스터 턴, 윌리엄; 헐리, 세실; Neth, Edward (2011). 화학 :원리와 반응 . Cengage Learning. ISBN 978-1-133-38694-0.
- Myers, Richard (2003). 화학의 기초 . 그린 우드 출판 그룹. ISBN 978-0-313-31664-7.