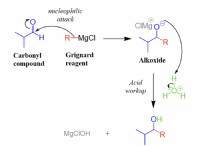
금속 산화물의 감소
금속 산화물의 감소는 금속 산화물이 원소 금속 형태로 변환되는 화학 공정이다. 이것은 금속 산화물에서 산소 원자를 제거함으로써 발생합니다.
여기에 고장이 있습니다 :
* 금속 산화물 : 금속의 산소 반응에 의해 형성된 화합물. 예로는 산화철 (Fe₂o₃), 구리 산화물 (CuO) 및 산화 알루미늄 (Alloolo₃)이 있습니다.
* 감소 : 물질이 전자를 얻는 화학 반응으로 산화 상태를 감소시킵니다.
* 원소 금속 : 가장 기본적인 형태의 순수한 금속.
작동 방식 :
금속 산화물의 감소는 환원제의 사용을 포함한다. 환원제는 전자를 쉽게 기증하여 금속 산화물이 전자를 얻고 산소 원자를 잃는 물질입니다.
일반적인 환원제는 다음과 같습니다.
* 탄소 (C) : 이것은 풍부함과 경제성으로 인해 산업 공정에서 널리 사용됩니다.
* 수소 (H₂) : 고온 응용에 종종 사용되는 깨끗하고 효율적인 환원제.
* 다른 금속 : 마그네슘 (mg) 또는 알루미늄 (AL)과 같은 금속은 강력한 환원제 역할을 할 수 있습니다.
예 :
환원제로서 탄소를 사용하여 산화철 (Fe₂O₃)의 철 (Fe) 감소 :
fe₃o₂ + 3c → 2fe + 3co
이 반응에서, 탄소는 산화철과 반응하여 철 및 일산화탄소 (CO)를 형성한다. 탄소 원자는 전자를 산화철에 기증하여 철 이온을 감소시키고 산소를 방출합니다.
응용 프로그램 :
금속 산화물의 감소는 다음을 포함하여 다양한 산업에서 중요한 과정입니다.
* 야금 : 철광석의 철과 같은 광석에서 금속을 추출합니다.
* 화학 : 다양한 응용 분야에 대한 순수한 금속 생산.
* 제조 : 특정 특성을 가진 합금 생성.
키 테이크 아웃 :
* 금속 산화물의 감소는 산화물에서 산소를 제거하는 과정입니다.
* 환원제는 전자를 기증하고 반응을 촉진하는 데 사용됩니다.
* 프로세스는 다양한 산업에서 광범위한 응용 프로그램을 가지고 있습니다.
이 설명은 금속 산화물 감소에 대한 기본적인 이해를 제공합니다. 특정 금속 산화물 및 감소 방법에 따라 다양한 뉘앙스와 특정 세부 사항이 있습니다.