알코올은 기능 그룹 -OH가 부착 된 유기 화합물입니다. 이것이 벤조노이드 고리에 부착되면 페놀 알코올이됩니다. 비즈니스 및 실험실에서 알코올 제조를위한 몇 가지 프로세스와 절차가 있습니다. 페놀은 C6H5OH의 화학적 공식을 갖는다. 백색 결정질 분말은 매우 가연성입니다. 이 분자에서 페닐과 하이드 록실기 사이에 공유 결합이 형성됩니다.
한때 페놀을 얻기 위해 콜 타르를 채굴해야했지만, 현재 석유 (연간 약 70 억 킬로그램)에서 막대한 양으로 생산됩니다. 제조 공정의 중요한 부분입니다. 대부분의 경우 플라스틱 및 기타 유사한 품목을 생산하는 데 사용됩니다.
알칸의 일반적인 준비 방법
알켄의 몇 가지 준비 방법이 있습니다. 가장 일반적인 것 중 일부는 아래에 나열되어 있습니다. 봅시다.
알킬 할라이드로부터 알켄을 제조하는 방법
알킬 할로드는 알켄에서 형성되며 탈수소화 방법을 통해 준비됩니다.
알킬 할라이드로부터 알켄을 제조하려면, 알코올성 KOH가있을 때도 고온에서 할라이드를 가열해야한다. 이 알코올성 코는 수산화 칼륨을 알코올에 용해시킴으로써 얻을 수있다.
반응이 발생하자마자, 단일 할로겐 산 분자가 제거되어 이중 결합을 일으킨다. 반응이 발생하는 가격은 알킬기 및 연결된 할로겐 원자에 의해 결정됩니다. Halo Atom은 수소 원자가 베타 탄소에서 방출되는 것과 동시에 알파 탄소에서 방출되기 때문에 이것을 1,2 제거라고도합니다.
.Vicinal Dihalides에서 알켄을 준비하는 방법
Dihalides Vicinal Dihalides에서 두 개의 할로겐 기관이 화합물에 배치 된 2 개의 인접 탄소 원자에 연결됩니다.
디 하이드가 아연 또는 요오드화 나트륨과 반응하는 경우, 할로겐 기관은 나트륨 또는 아연을 형성하여 이중 결합의 형성으로 이끌어냅니다. 이것은 탈할 로겐이라고 할 수 있습니다.
알코올로부터 알켄을 준비하는 방법
알코올은 집중된 황산과 반응 할 때마다, 이중 결합 또는 알켄을 형성하는 물 분자가 제거됩니다. 산이 존재할 때 물 분자가 제거됨에 따라 반응은 종종 알코올의 산성 탈수라고합니다.
알코올 준비 방법
비즈니스 및 실험실에서 알코올 제조를위한 몇 가지 프로세스와 절차가 있습니다. 더 잘 이해하기 위해 하나씩 검토합시다. .
알킬 할라이드로부터 알코올 제조
물이 존재하는 경우 알킬 할라이드가 가수 분해
이름에서 알 수 있듯이 이것은 친 핵성 치환 과정입니다. 장기적 으로이 전략은 특히 효과적이지 않습니다. 이는 외부 조건에 의존하고 알켄 부산물은 제거 반응에 의해 얻어 질 수 있기 때문이다.
R-X + H2O → R-OH + HX
Grignard 합성을 통한 알코올 제조
그 ignard 합성에서 얻은 알코올의 종류는 반응에 사용되는 카르 보닐 분자에 따라 다릅니다. 반면에, 알데히드는 2 차 알코올을 생산하고 R2CO는 3 차 알코올을 생산합니다.
반응은 다음과 같이 진행됩니다 :
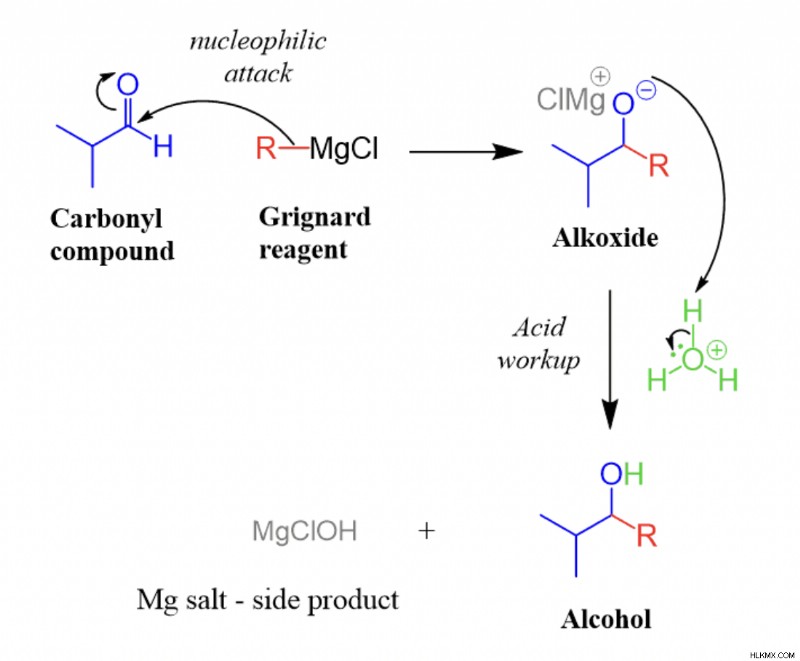
알코올 준비는 알데히드와 케톤을 줄임으로써 형성 될 수 있습니다. 알데히드는 1 차 알코올로 전환 될 수있는 반면, 케톤은 보조로 전환 될 수있다. 리튬 알루미늄 수 소화물, LIALH4 또는 NABH4와 같은 화학 환원제의 촉매 수소화는이 작업을 수행하는 데 사용될 수 있습니다.
이러한 감소 절차는 일부 알코올을 합성하는 데 중요하며, 이는 카르 보닐 등가보다 환경에서 덜 일반적으로 이용 가능합니다. 나트륨 보로 하이드 라이드 (NABH4)는 탄소-탄소 이중 결합, 심지어 카르 보닐 그룹과 결합 된 것조차 파괴하지 않는다는 것을 기억하는 것이 중요하다.
.환원 공정은 산을 알코올로 변환합니다
리튬 알루미늄 수 소화물 (Lialh4)은 산을 알코올로 전환시키는 희귀 시약입니다. Lialh4는 리튬 알루미늄 수 소화물을 만드는 데 사용됩니다. LIALH4는 산 및 기타 화합물을 감소시키기위한 실험실에서 일반적인 성분입니다. 높은 수율로 인해 인기가 있습니다. B2H6은 산을 알코올로 감소시키는 또 다른 시약입니다.
페놀 준비의 일반적인 방법
Haloarenes는 페놀을 만드는 데 사용됩니다.
클로로 벤젠은 벤젠 고리가 염소 원자로 대체 될 때 형성된 할로 아렌이다. 623K 및 320 ATM에서, 클로로 벤젠이 수산화 나트륨과 반응 할 때 페녹 시드 나트륨이 얻어진다. 산성화에서, 가열 소듐 페녹 시드는 페놀을 생성한다.
300 atm, 623k hcl
c6h5cl +naoh ——————> c6h5ona ————-> c6h5oh
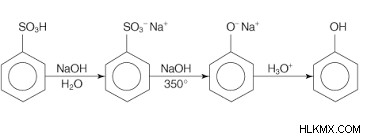
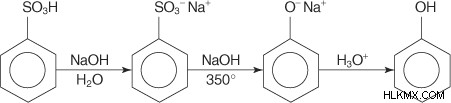
벤젠 설포 산으로부터의 페놀 제조 :
설 포닉 벤젠 산은 벤젠을 올레 움과 반응하여 만들어집니다. 그런 다음 고온에서 수산화 나트륨 (용융 상태)을 융합시켜 페녹 시드 나트륨을 초래합니다. 마지막으로, 페녹 시드 나트륨이 산성화되면 페놀을 생성합니다.
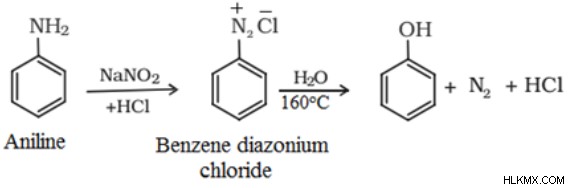
디아조 늄 염의 페놀 준비 :
diazonium salts는 1 차 방향족 아민이 273-278 k에서 아질성 (nano2+ hcl) 산으로 처리 될 때 형성됩니다.
이 디아조 늄 염은 물로 가열 될 때 마침내 페놀에 가수 분해됩니다. 희석 된 산은 디아 조 늄 염을 치료하는 데 사용될 수 있으며 페놀을 얻을 수 있습니다.
Cumene을 사용한 페놀 준비 :
Cumene (Isopropylbenzene)이 공기의 존재하에 산화 될 때 Cumene hydroperoxide가 생성됩니다. Cumene hydroperoxide는 희석산과 상호 작용하여 페놀을 형성합니다. 아세톤은이 과정의 두드러진 부산물이며 정화를 요구합니다.
결론 :
Alkenes의 준비는 다양한 준비 방법의 중요한 개념이 화학 분야에서 당신에게 도움이 될 것입니다.
우리는 다른 화합물과 달리 알코올이 탄소 사슬에 직접 연결된 하나 이상의 하이드 록실 (-OH) 그룹을 포함하는 분자 인 방법을 보았습니다. 자유 형태의 알코올은 본질적으로 발견되지 않습니다. 대신, 그들은 다양한 식물의 꽃, 잎 및 줄기에서 추출한 필수 또는 휘발성 오일에서 주로 발견됩니다.
페놀은 무색, 산성이며 바늘 모양의 고형물입니다. 사람들은 그날 콜 타르에서 페놀을 만들었습니다. 길고 복잡한 과정이었습니다. 그러나 실험실에서 페놀을 합성하는 새로운 방법은 기술 개선으로 나타났습니다