* 전자 전달 : 산화 및 감소의 기본 기초는 전자의 전달입니다.
* 산화 : 물질은 전자를 잃습니다 (더 양성이됩니다).
* 감소 : 물질은 전자를 얻습니다 (더 부정적인 것).
* 청구 보존 : 전자는 음전하가있는 기본 입자이므로 시스템의 총 전하는 균형을 유지해야합니다. 하나의 원자 또는 분자가 전자 (산화)를 잃는 경우 다른 하나는 전자를 얻어야합니다 (환원).
* 산화 환원 반응 : 전자의 동시 전달은 산화 환원 반응 로 알려져 있습니다. . 이러한 반응은 다음을 포함하여 많은 생물학적 및 화학적 과정에 필수적입니다.
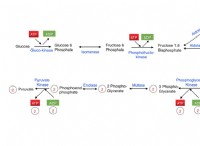
* 세포 호흡 : 에너지를 생산하기 위해 음식을 분해하는 과정에는 전자의 전달이 포함됩니다.
* 광합성 : 식물은 햇빛을 사용하여 이산화탄소와 물을 포도당으로 변환하며, 이는 전자 전달이 포함됩니다.
* 부식 : 철의 녹슬은 산화 환원 반응입니다.
* 연소 : 연료 연소는 산화 환원 반응입니다.
예 :
마그네슘 금속의 염산과의 간단한 반응을 고려하십시오.
* mg (s) + 2hcl (aq) → mgcl2 (aq) + h2 (g)
이 반응에서 :
* 마그네슘 (mg) 산화되어 있습니다 :두 개의 전자가 mg² in이됩니다.
* 수소 (H) 감소 :전자가 h₂이되기 위해 전자를 얻습니다.
마그네슘에 의한 전자의 손실은 수소에 의한 전자의 이득에 의해 정확하게 균형을 이룹니다. 이것이 바로 산화와 감소가 항상 결합되는 이유입니다.
본질적으로 산화와 감소는 동일한 동전의 양면입니다. 하나는 다른 하나 없이는 발생할 수 없으며, 전하 보존 및 광범위한 화학 반응을 유도 할 수 없습니다.