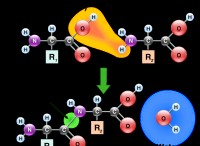
1. 원자 궤도와 관련된
* 탄소 : 탄소에는 2S 및 2P 원자 궤도가 있습니다.
* 산소 : 산소는 또한 2S 및 2P 원자 궤도를 갖는다.
2. 분자 궤도 형성
* 시그마 본딩 (σ) : 탄소 및 산소의 2S 궤도는 결합되어 2 개의 σ 결합 궤도를 형성한다. 이들 σ 궤도 중 하나는 에너지 (결합)가 낮고 다른 하나는 더 높고 (안티본딩, *로 표시됨) 더 높다.
* pi 결합 (π) : 탄소 및 산소의 2p 궤도는 결합되어 두 세트의 π 결합 궤도를 형성한다. 한 세트는 에너지 (결합)가 낮고 다른 세트는 더 높고 다른 세트는 더 높습니다 (안티 본딩, *로 표시).
3. 분자 궤도 다이어그램
Co₂에 대한 분자 궤도 다이어그램은 다음과 같습니다.
```
*σ2p (안티본 딩)
*π2p (안티본 딩)
π2p (결합)
σ2p (결합)
*σ2S (안티본 딩)
σ2S (결합)
```
4. 궤도를 채우는
* Co 16는 총 16 개의 원자가 전자 (4 개의 탄소에서 4 개, 각 산소에서 6 개)를 가지고 있습니다.
*이 전자는 에너지를 증가시키기 위해 분자 궤도를 채 웁니다.
* 가장 낮은 2 개의 σ 궤도와 2 개의 π 결합 궤도가 채워져 총 10 개의 전자가 제공됩니다.
*나머지 6 개의 전자는 *σ2s, *π2p 및 *σ2p 항의 궤도를 차지합니다.
5. 특성 및 결합
* 선형 형상 : Co₂의 분자 궤도 구조는 중심에 탄소 원자와 양쪽에 2 개의 산소 원자를 갖는 선형 모양을 초래한다.
* 강한 채권 : 채워진 결합 궤도는 탄소와 산소 원자 사이에 강력하고 안정적인 결합을 생성합니다.
* 비극성 : 전자 밀도가 골고루 분포되기 때문에 분자는 비극성입니다.
키 포인트 :
* 분자 궤도 다이어그램은 CO₂의 결합, 안정성 및 특성을 설명하는 데 도움이됩니다.
* COS의 강한 결합은 그것을 매우 안정적인 분자로 만듭니다.
분자 궤도 구조의 특정 측면에 대한 자세한 설명을 원한다면 알려주십시오!