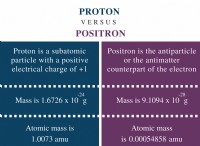
암모늄 이온의 도트 및 교차 다이어그램 (NH₄⁺)
암모늄 이온의 형성을위한 도트와 크로스 다이어그램을 그리는 방법은 다음과 같습니다.
1. 개별 원자 :
* 질소 (N) : 5 개의 원자가 전자 (십자가로 표시)가 있습니다.
* 수소 (H) : 1 개의 원자가 전자 (도트로 표시)가 있습니다.
2. 본딩 :
* 질소는 옥셋을 완성하기 위해 3 개의 더 많은 전자가 필요합니다.
* 각 수소 원자는 듀엣을 완성하기 위해 1 개의 전자가 필요합니다.
* 질소는 4 개의 수소 원자와 5 개의 원자가 전자를 공유하여 4 개의 공유 결합을 형성합니다.
* 각 수소 원자는 결합에 1 전자를 기여합니다.
3. 암모늄 이온 :
* 분자는 이제 질소 원자를 둘러싸고있는 8 개의 전자 (질소에서 4 개, 수소 원자에서 4 개)를 가지고 있습니다.
* 이것은 질소 원자가 하나의 전자를 잃어 버렸기 때문에 공식적으로 양성으로 만듭니다.
* 암모늄 이온은 포뮬러 NH₄⁺로 형성됩니다.
다이어그램 :
```
시간
|
H -n -h
|
시간
+
```
상징의 설명 :
* n : 질소 원자
* h : 수소 원자
* x : 질소의 원자가 전자
* · : 수소의 원자가 전자
* -: 공유 결합 (공유 전자 쌍)
* +: 암모늄 이온에 대한 양전하
키 포인트 :
* 암모늄 이온은 공유 결합 에 의해 형성됩니다. 4 개의 수소 원자가있는 질소 원자의.
* 질소 원자는 공식적인 양전하 를 갖는다 하나의 전자의 손실로 인해.
* 암모늄 이온은 사면체 모양 를 갖는다 , 중심에 질소 원자와 모서리에 수소 원자가 있으면.
이 다이어그램은 결합 전자의 단순화 된 표현을 통해 암모늄 이온의 형성과 그의 화학 구조를 보여줍니다.