고귀한 금속은 공기에 노출 될 때 산화 및 부식에 내성이있는 금속 그룹입니다. 이 금속에 의해 나타난 상대 론적 영향으로 인해 다른 조건에서 안정적 일 수있는 능력이 있습니다.
어느 시점에서, 당신은 누군가가“그가 너무 귀족”이라고 말하거나“이 나라의 고귀한 역사에 대해 알고 있었습니까?”라고 말한 것을 들었을 것입니다. 그러나 우리는 누군가가“여기에 고귀한 금속이 있습니다!”라고 말하는 것을 거의 듣지 못합니다. 이미 알고 있듯이 영어는 매우 이상한 언어이며“고귀한”이라는 단어는 다른 영역이나 연구 분야에서 다른 의미를 갖습니다. 화학 에서이 용어는 부식과 산화에 내성이있는 금속으로 정의되며, 원자 물리학에서 정의는 원자의 전자 구성 (원자의 다른 쉘에서 전자의 분포)을 다룹니다.
8 가지 가장 흔한 고귀한 금속에는 금 (Ag),은 (AU), 백금 (PT), 로듐 (RH), Iridium (IR), 루테늄 (RU), Osmium (OS) 및 팔라듐 (PD)이 포함됩니다. 아시다시피, 처음 3 개는 종종 보석이나 다른 장식품을 만드는 데 사용됩니다. 이것에 대한 유일한 이유는 공기에 노출 될 때 변화에 대한 불활성과 저항 때문입니다. 이 금속이 '고귀한'으로 만드는 이유를 이해하려면 화학의 기본부터 시작하겠습니다!
주기율표에 고귀한 금속이 어디에 있습니까?
주기율표는 1869 년 러시아 화학자 인 Dimitri Mendeleev에 의해 만들어졌습니다. 원자 수, 전자 구성 및 화학적 특성의 유사성에 따라 배열 된 화학 요소의 디스플레이입니다. 오늘날 주기율표에는 118 개의 알려진 요소가 있습니다. 요소는 화학적 거동에 따라 그룹 및 기간으로 배열됩니다. 고귀한 금속은 테이블의 중앙에 위치하고 있으며 전이 금속 그룹에 속합니다. 모든 전이 금속은 금속 특성을 가지며 전기 도체가 우수합니다.
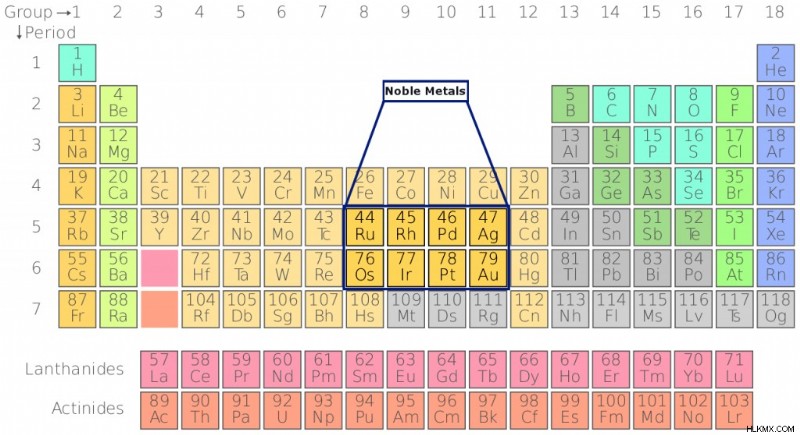
주기율표에서 8 개의 일반적인 고귀한 금속의 위치 (사진 크레디트 :SandBH / Wikipedia Commons)
고귀한 금속의 화학은 무엇입니까?
고귀한 금속이 왜 가장 반응성이 낮은 금속인지 이해하려면 전자 구성을 아는 것이 중요합니다. 원소의 화학적 반응성은 핵 주위의 전자의 배열에 의해 영향을받으며, 이는 원자가 안정적으로 유지되도록한다. 요소가 전자 쉘을 완전히 채우면 안정성이 달성됩니다.
대학에서 졸린 화학 강의 중 어느 시점에서, 당신은 보어 모델 뒤에있는 Niels Bohr이라는 이름을 가질 수 있습니다. 그는 원자가 중성자와 양성자를 함유하는 핵을 가지고 있으며 전자는 특정 거리의 전자 껍질의 핵 주위에 회전한다고 밝혔다.
.
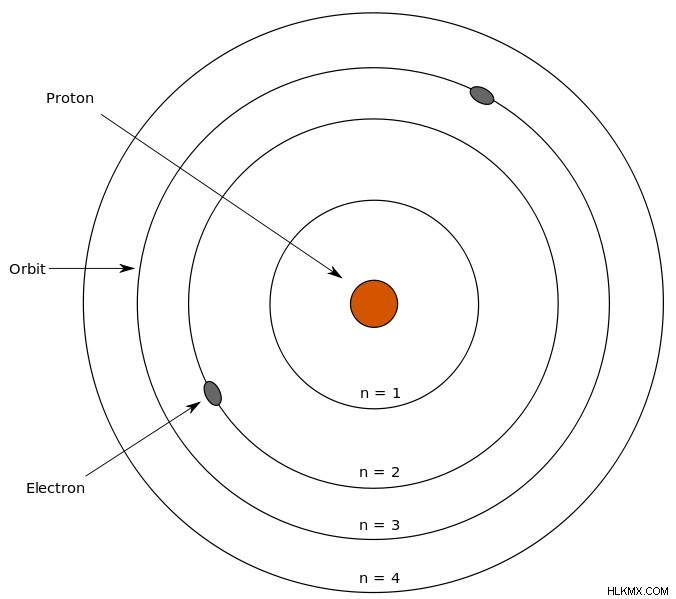
Bohr 모델의 그림. (사진 크레디트 :Sharon Bewick/Wikimedia Commons)
전자는 다른 껍질에서 회전하고 특정 에너지 수준을 가지고 있습니다. 이 에너지 수준은 우리가 핵에서 멀어지면서 증가합니다. 이 에너지 수준은 1, 2, 3, 4 등으로 번호가 매겨집니다. 또한, K, L, M 및 N으로 지정된 각각의 주요 에너지 수준 또는 전자 쉘은 2N2 전자를 함유하며, 여기서 N은 레벨의 수에 해당합니다.
첫 번째 레벨은 2 (12) 전자 =2 전자
를 갖는다두 번째 레벨에는 2 (22) 전자 =8 전자
가 있습니다세 번째와 네 번째 레벨은 18 및 32 전자를 가지며 동일한 방식으로 계산됩니다. 우리가 핵에서 멀어 질 때 전자는 에너지 수준이 높습니다. 따라서, 6 차 에너지 수준의 전자는 첫 번째 수준의 전자보다 더 많은 에너지를 갖습니다. 전자는 먼저 낮은 에너지 수준을 채운 다음 바깥쪽으로 이동합니다. 때로는 전자가 완성 할 수 없습니다 y 껍질을 채우면서 원자가 전자를 일으킨다. 이 가장 바깥 전자는 원자의 반응성을 담당합니다. 이것은 우리가 전자 에너지 수준에 대해 이야기 할 때 고려해야 할 가장 중요한 측면 중 하나입니다.
주요 질문에 대답하기 전에 계속 다루어야 할 몇 가지 기본 사항이 있기 때문에 전부는 아닙니다. 전자 쉘과 관련된 몇 가지 세부 사항을 살펴 보겠습니다.
하위 쉘과 궤도는 무엇입니까?
모든 쉘 (k, l, m 또는 n)은 하나 이상의 하위 쉘을 포함하며 모든 서브 쉘에는 원자 궤도가 포함됩니다. 영화 Inception의 장면처럼 거의 느껴지고 우리는 한 껍질에서 다른 껍질에서 다른 껍질로, 다른 껍질로 이동합니다. 마침내 고귀한 금속의 화학을 이해할 때까지. 물건을 단순화하려면 Tug-O'-War 게임에서 전자를 플레이어로 상상하십시오. 각 전자는 선의 중심점 (핵)을 근처에 원합니다. 핵에서 가장 먼 전자는 핵에 더 가깝게하기 위해 많은 양의 에너지를 생성하며, 게임에서 로프 끝에 가장 강한 플레이어를 넣는 것과 비슷합니다. 그러나 Tug-O'-War의 플레이어는 전자 껍질의 경우와 마찬가지로 로프 주위에 모여있는 대신 직선으로 위치합니다.
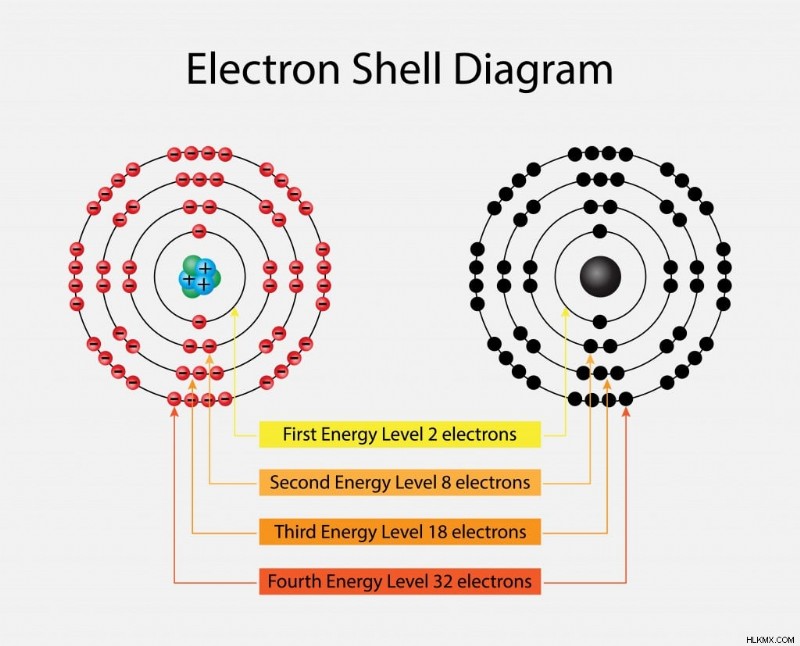
다양한 에너지 수준을 보여주는 전자 쉘. (사진 크레디트 :nasky/ shutterstock)
마찬가지로, 전자는 껍질을 과도하게 막지 않고 라이브를 따르고 살아있는 정책을 보자! 그것들은 s, p, d 로 지정된 서브 쉘로 잘 배포됩니다. 및 f, 2 개 이상의 궤도를 포함합니다. 모든 궤도에는 2 개의 전자 만 포함되어 동일한 서브 쉘에서 많은 궤도가 발생합니다. 2 개의 전자는 동일한 궤도에서 반대 방향으로 회전하여 에너지 차이를 일으킨다. f 의 궤도에있는 전자 서브 쉘은 s 의 것보다 더 활기차고 있습니다 하위 쉘.
전자 쉘이 완전히 채워진 이러한 요소는 원자가 전자가 없기 때문에 다른 요소보다 더 안정적입니다.
왜 고귀한 금속이 가장 반응성이 가장 낮습니까?
위에서 언급 한 바와 같이, 원자가 전자는 다른 원소와 상호 작용하고 화합물을 형성하는 요소의 능력을 담당한다. 더 잘 이해하기 위해 금의 화학을 이해하기 위해 물건을 좁히겠습니다. 금 (79au)의 전자 구성을 면밀히 관찰 할 때, [xe] 4F14 5D10 6S1 (여기서 XE는 가장 가까운 귀족 가스입니다. 4, 5 및 6은 에너지 수준을위한 것이며, 후퍼 스크립트는 각 하위 껍질에 존재하는 전자의 수를 묘사합니다). 따라서 골드는 가장 바깥 쪽 쉘에 하나의 자유 전자가 있기 때문에 반응하지 않아야합니까?
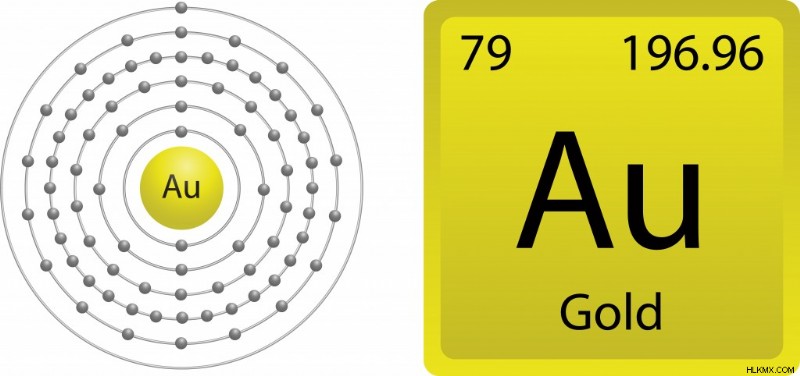
가장 바깥 쪽 쉘에 단일 전자가있는 금의 전자 구성. (사진 크레디트 :Gstraub/ Shutterstock)
금은 원자가 79를 가지므로 상대 론적 효과를 나타낼 수 있습니다. 금의 무거운 핵으로 인해 전자는 매우 빠르게 이동하므로 s 전자는 d 보다 더 강하게 결합된다 및 f 쉘 전자. 이 상대 론적 전자는 질량을 얻어 6 를 유발합니다 계약 궤도. 이 수축은 전자가 핵에 더 단단히 결합되어 반응에 대해 이용할 수 없게됩니다. 따라서, 가장 바깥 쪽 쉘에 유리 전자가 있음에도 불구하고 금은 산화에 저항하는 독특한 특성을 가지고 있습니다.
결론적으로, 고귀한 금속은 화학적 배열 및 각 껍질에서 전자의 위치로 인해 산화 및 부식에 덜 반응성이있다. 이를 통해 특정 금속은 치과 주조로, 또한 금속 둔화, 부식 또는 반응에 대한 두려움없이 다양한 장신구로 사용할 수 있습니다!







