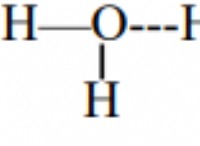* NaCl (염화나트륨) :NaCl은 이온 성 화합물이며, 이는 양으로 하전 된 나트륨 이온 (Na+)과 음으로 하전 된 클로라이드 이온 (Cl-) 사이의 강한 정전기 인력에 의해 함께 유지됩니다. 이러한 이온 성 결합은 매우 강하고 파손하려면 상당한 양의 에너지가 필요하므로 융점이 높습니다 (801 ° C).
* CH4 (메탄) :메탄은 공유 화합물이며, 이는 탄소와 수소 원자 사이의 전자 공유에 의해 함께 유지됩니다. 이 공유 결합은 분자 내에서 강하지 만 NaCl의 이온 결합보다 약합니다. 또한, 메탄 분자는 약한 런던 분산 세력에 의해 함께 유지되며, 이는 분자들 사이의 일시적인 매력이다. 이 약한 힘은 쉽게 극복되어 매우 낮은 융점 (-182.5 ° C)을 초래합니다.
요약 :
* 더 강한 결합 : NaCl의 이온 결합은 CH4의 공유 결합보다 훨씬 강하다.
* 약한 분자간 힘 : CH4는 분자간 힘이 매우 약해서 용해하기 쉽습니다.
결합 강도의 상당한 차이는 융점의 큰 차이를 직접 해석합니다.