Oxoacids는 본질적으로 산소를 함유하는 산입니다. 옥소 세포는 수소, 산소 및 다른 원소를 함유하는 산입니다. 황의 옥소 세이드는 소금과 함께 4 개의 상태, 소금, 소금 및 용액 상태 중 하나에서 찾을 수 있습니다. 황의 옥소 세포는 적어도 하나의 s =O 결합 및 하나의 S-OH 또는 S-SH 결합을 함유한다. 황은 산소에 대한 사면체 구조를 보여줍니다. 이러한 산 중 일부는 불안정하고 분리 할 수 없습니다. 그들은 일반적으로 수용액이나 소금의 형태로 존재합니다.
옥소 세포에서 황은 산소에 관한 사면체 구조를 보여줍니다. 세기적으로,이 옥소 세드는 최소 1 개의 s =O 결합 및 하나의 S-OH 결합을 갖는다. 또한이 옥소 세포에서 말단 퍼 옥사이드 그룹, 말기 S =S, 말단 및 브리징 산소 원자를 관찰합니다. 이제 가장 인기있는 옥소 산과 그 특성을 살펴 보겠습니다.
황 정의의 Oxoacid :
Oxoacids는 산소를 함유하는 산입니다. 황의 옥소 세포는 황, 산소 및 수소를 함유하는 화합물입니다. 가장 중요한 산업적으로 사용되는 옥소 세포는 황산 (H2SO4)입니다. 황은 산소에 관한 옥소 세포에 사면체 구조를 가지고있다.
황산 :
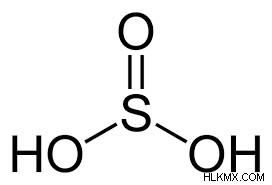
황산은 가장 흔한 황 옥소 산 중 하나입니다. 그것은 일종의 디 프로토 산입니다 (두 개의 양성자를 제공하는 이온). 황산의 하나의 원자는 황산의 2 개의 하이드 록실기에 연결되고 나머지 2 개의 산소 원자는 황 원자와 파이 연결을 형성합니다.
황산의구조 :
황산에는 사면체 기하학이 있습니다. 황 산소 링크의 결합 길이는 S-OH 결합의 결합 길이보다 짧기 때문에, 산소 원자는 OH 그룹을 격퇴시킨다. 결과적으로, 황과 산소의 이중 결합에서의 결합 각은 황과 산소의 단일 결합에서 결합 각보다 큽니다. 접촉 방법에 의해 산업적으로 제조됩니다.
특성 :
-
황산은 물에 용해됩니다. 용해되면 막대한 양의 열이 해방됩니다. 위험한 반응입니다. 따라서 농축 된 산은 물에 매우 천천히 첨가되어 끊임없이 저어줍니다.
-
끊임없이 끓는 혼합물로 응축됩니다.
-
젖은 공기에 노출 될 때 매운 악취를 방출합니다.
-
피부와 접촉 할 때 심각한 화상을 유발합니다.
황산의 사용 :
황산은 가장 중요한 화합물 중 하나이며, 실질적으로 모든 산업에 응용 프로그램이 있습니다.
-
그것은 황산 암모늄, 석회의 수퍼 포스페이트 등과 같은 비료의 생산에 사용됩니다.
-
그것은 염료, 폭발물 및 제약 생산에 사용됩니다.
-
그것은 HCl, HNO3 등과 같은 산의 생산에 사용됩니다.
-
다양한 화학 물질의 생산에 사용됩니다.
-
아연 도금, 에나 멜링 및 야금 작전에 사용됩니다
황산 :
황산은 디 프로산으로, 이는 두 양성자를 이온화한다는 것을 의미합니다. 하나의 황 원자는 황산 중 2 개의 하이드 록실기에 결합되고, 하나의 산소 원자는 황 원자와 PI 결합을 형성한다. 이산화황은 물에 용해되어 그것을 만들 수 있습니다.
퍼 옥소 디 설 푸르 산 :
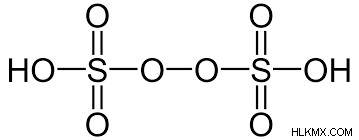
+6 산화 상태의 황은 퍼 옥소 디 설 푸르 산에 존재한다. 결과적으로, 그것은 강력한 산화제이며 자연에서 고도로 폭발성 물질입니다. Marshall의 산은 일반적인 이름입니다. 그것은 두 황 원자 사이에 다리를 형성하는 하나의 과산화물 그룹을 가지고 있습니다.

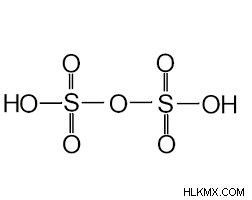
피로 술로 산 :
oleum은 피로 술로 산의 또 다른 이름입니다. 분자 질량에서 178.13 g/mol을 갖는다. 황산의 무수물, 융점은 36 ℃ 인 흰색의 결정질 고체이다. 과량의 황화 황은 황산과 결합 되어이 물질을 생산합니다. 이것이 사람들이 반응하는 방식입니다 :
h2so4 + so3 → h2s2o7
티오 설파 산 :
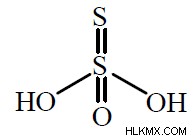
Thiosulfuric acid는 공식 H2S2O3을 갖는 무기 화합물입니다. 기본적이고 쉽게 접근 할 수있는 불안정한 화합물로서 학업의 관심을 끌었습니다. 응용 프로그램 수는 제한되어 있습니다.
결론 :
황 옥소 세포는 황, 산소 및 수소를 함유하는 화학적 화합물입니다. 가장 잘 알려진 가장 중요한 산업은 황산입니다. 유황에는 여러 옥소 세포가 있습니다. 그러나이 중 일부는 소금에서만 알려져 있습니다.