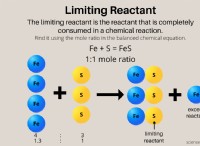
1. 어떤 황화물 화합물이 반응 하는가? 많은 황화물 (예를 들어, 황화 나트륨 (NAAS), 황화수소 (HIS), 철 황화물 (FES))이 있습니다.
2. 반응에서 다른 반응물은 무엇입니까? 생산 된 알루미늄의 양은 반응의 화학량 론에 따라 다르며, 다른 반응물과 그 양을 알아야합니다.
다음은 이러한 유형의 문제를 해결하는 방법에 대한 일반적인 예입니다.
반응이 다음과 같이 가정 해 봅시다.
3 na₂s + 2 alcl₃ → 2 al (OH) ₃ + 6 naCl
al (OH) ₃ ₃ :의 그램을 계산합니다
1. na₂s의 그램을 두더지로 변환합니다.
- NAIS (2 x 23 g/mol na + 32 g/mol s =78 g/mol)의 몰 질량을 찾으십시오.
- 주어진 NAIS의 질량을 몰 질량으로 나눕니다.
2. 화학량 론을 사용하여 Al (OH) ₃ :의 두더지를 찾으십시오
- 균형 방정식은 3 몰의 NAIS가 2 몰의 Al (OH)을 생성 함을 보여줍니다.
- 비율을 설정하십시오 :(0.201 mol na₂s / 3 mol na₂s) =(x mol al (OH) ₃ / 2 mol al (OH) ₃)
- x :x =0.134 mol al (OH) ₃에 대한 해결
3. Al (OH)의 두더지를 그램으로 변환 :
- Al (OH) ₃ (27 g/mol al + 3 x 16 g/mol O + 3 x 1 g/mol H =78 g/mol)의 몰 질량을 찾으십시오.
- Al (OH)의 두더지에 몰 질량으로 곱하십시오.
따라서이 예에서는 10.5 그램의 알루미늄 수산화물이 얻어 질 것입니다.
완전한 반응과 다른 반응물을 제공하면 수산화 알루미늄 그램을 계산하는 데 도움을 줄 수 있습니다.