화학에서 제한 반응물 화학 반응에 완전히 사용되는 반응물입니다. 제한 시약 라고도합니다 반응물과 시약이 현대 화학에서 항상 같은 것은 아닙니다. 정의, 찾는 방법 및 예제 문제를 포함하여 제한 반응물에 대해 알아야 할 사항은 다음과 같습니다.
반응물 정의 제한
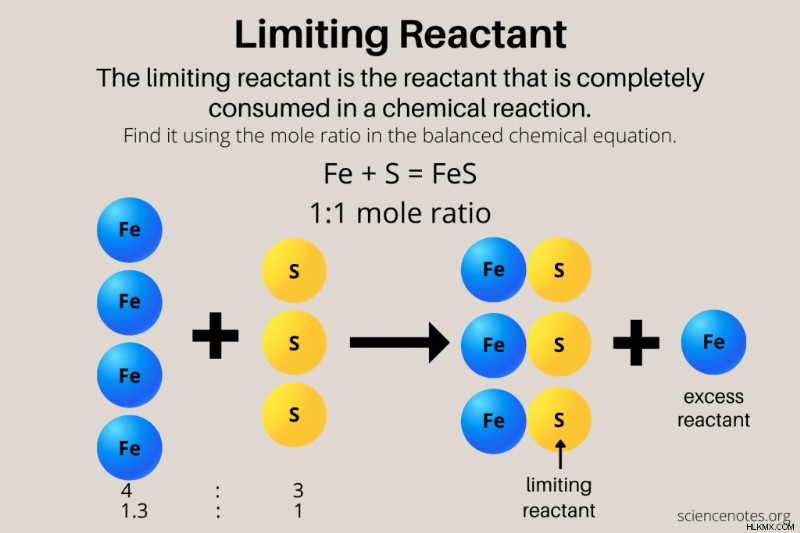
제한 반응물은 화학 반응을 "제한"하거나 생산할 수있는 생성물의 양을 결정하는 반응물입니다. 화학량 측정법 또는 반응물과 생성물 사이의 두더지 비율을 기반으로합니다. 반응물을 결합하면 항상 서로 균형을 맞추는 금액을 사용하지는 않습니다.
예를 들어, 핫도그 패키지와 빵 패키지를 구입하면 일반적으로 10 개의 핫도그와 8 개의 빵을 얻을 수 있습니다 (아마도 빵 회사는 제품을 더 많이 판매 할 수 있습니다). 빵이 달린 핫도그는 몇 개를 만들 수 있습니까? 핫도그와 빵 사이의 이상적인 비율은 1 :1이지만 10 :8 또는 1 :0.8이 있습니다. 핫도그가 부족하기 전에 모든 빵을 사용하므로 빵은 제한적인 반응물입니다. 남은 핫도그는 과도한 반응물 입니다 . 제한 반응물은 이론적 수율을 결정합니다. 이 경우, 이론적 수율은 빵이있는 8 개의 핫도그입니다.
화학 반응은 핫도그 및 빵 예와 매우 비슷합니다. 예를 들어, 철 (Fe)과 황 (들) 사이의 반응을 고려하여 황화물 (FES)을 형성합니다. 핫도그 및 빵과 같은 철과 황은 1 :1 비율로 반응합니다 :
fe (s) + s (s) → fes (s)
이상적인 상황에서는 각 물질의 무더비리가 동일합니다. 주기적인 테이블을 사용하고 철과 황의 원자 질량을보고 두더지의 수를 그램으로 변환하여 무게를 측정 할 수 있습니다. 따라서 55.85 그램의 철분과 32.06 그램의 황을 반응하면 완전히 반응하여 황화철을 형성합니다. 철과 황은 제한 반응물입니다. 각 화학 물질의 절반 또는 각 화학 물질의 5 배를 사용하는 경우 철과 황이 같은 몰량으로 존재하는 한 결과가 동일합니다.
그러나 일반적으로 각각의 각 반응물이 주어 지므로 하나의 반응물이 사용되며 (제한 반응물) 일부 남은 반응물 (과량 반응물)이 있습니다. 46 그램의 철과 32 그램의 황이 있다고 가정 해 봅시다. 제한 반응물은 무엇입니까?
제한 반응물을 찾는 방법
제한 반응물을 찾는 두 가지 주요 방법이 있습니다. 두 경우 모두 균형 화학 방정식과 반응물 및 제품의 몰 수로 시작합니다. 두더지의 수가 주어지면 훌륭합니다! 일반적으로 그램에 질량이 있고 그램을 두더지로 변환합니다. 그런 다음 반응물의 두더지 비율을 비교하거나 어떤 반응물이 더 적은 양의 생성물을 생성하는지 알 수 있습니다.
반응물의 두더지 비교
- 화학 방정식의 균형.
- 균형 방정식에서 반응물 사이의 두더지 비율을 찾으십시오. 반응물 및 생성물 앞의 계수는 두더지 비율을 제공합니다. 계수가 없다면 1 몰이 있음을 의미합니다.
- 그램을 두더지로 변환합니다.
- 균형 방정식으로부터 실제 반응물 양의 두더지 수를 두더지 비교.
- 짧은 반응물은 제한 반응물입니다.
예를 들어, 46 그램의 철과 32 그램의 황 사이의 반응에서 :
- 균형 방정식을 작성하십시오 :Fe (s) + s (s) → fes (s)
- 반응물 사이의 두더지 비율 찾기 :1 Fe :1 S
- 그램을 두더지로 변환 :46 그램 Fe =46 g / 55.85 g / mol =0.82 mol; 23 그램 S =23 g/32.06 g/mol =0.72 mol
- 실제 비교와 이상적인 두더지 비율 비교 :0.82 mol fe :0.72 mol s 가 있습니다.
- 어느 것이 짧게 나오나요? Fe와 S는 1 :1 비율로 반응하고 S의 두더지가 적기 때문에 황은 제한 반응물입니다.
제품의 양
- 화학 방정식의 균형.
- 실제 금액을 두더지로 변환합니다.
- 균형 방정식에서 두더지 비율을 사용하여 각 제품의 전체 양을 사용하면 제품의 두더지를 찾으십시오. 따라서 두 개의 반응물이있는 경우 여기에는 두 가지 계산이 있습니다. 3 개의 반응물이있는 경우 세 가지 계산이 있습니다. 귀하의 반응이 하나 이상의 제품을 형성하면 하나를 선택하십시오.
- 더 적은 양의 생성물을 생성하는 반응물은 제한 반응물입니다. 더 많은 양의 제품을 생성하는 것은 과도한 반응물입니다.
원한다면 실제로 사용되는 양으로부터 과량 반응물의 몰을 빼서 과량 반응물의 양을 계산하십시오. 그런 다음 두더지 수를 그램으로 변환하십시오.
다시, 46 그램의 철과 32 그램의 황 사이의 반응의 예를 사용해 봅시다.
- 균형 방정식을 작성하십시오 :Fe (s) + s (s) → fes (s) [1 몰의 반응물이 1 몰의 제품을 생성한다는 점에 유의하십시오.] .
- 그램을 두더지로 변환 :46 그램 Fe =46 g / 55.85 g / mol =0.82 mol; 23 그램 S =23 g/32.06 g/mol =0.72 mol
- 각 반응물에서 이론적 인 생성물을 찾으십시오. 반응물 :생성물 비율은 1 :1이기 때문에 모든 S.
- 황의 양은 소량의 철 황화물을 생성하므로 황은 제한 반응물입니다.
예
다음은 반응 제한을 찾는 방법을 보여주는 또 다른 예입니다.
35.60 그램의 수산화 나트륨과 30.80 그램의 인산을 반응하여 인산 나트륨 및 물을 형성 할 때 제한 반응물을 찾으십시오.
.먼저 화학 공식과 균형 화학적 방정식이 필요합니다.
3 NaOH (aq) + H 3 po 4 (aq) → Na 3 po 4 (aq) + 3 H 2 o (l)
반응물 사이의 두더지 비율은 3 NaOH :1 H 3 입니다. po 4
수산화 나트륨 및 인산 나트륨의 수를 찾으십시오. 주기율표에서 원자 질량 사용 :
- naoh의 몰 질량 =40.00 그램/몰
- H 3의 몰 질량 po 4 =98.00 그램/mol
NaOH의 두더지 =35.60 g / 40.00 g / mol =0.89 mol
H 3 의 두더지 po 4 =30.80 g/98.00 g/mol =0.31 mol
수산화 나트륨과 인산 사이의 실제 몰비는 0.89 :0.31 =2.87입니다.
수산화 나트륨과 인산 간의 이상적인 몰비는 3 :1 =3.00입니다.
두더지 비율은 3 미만이므로 NAOH가 제한 반응물이라는 것을 알고 있습니다. 비율이 3보다 크면 인산은 제한 반응물 일 것입니다. 물론, 당신은 동일한 대답을 제품과 비교하여 문제를 해결합니다.
참조
- Brady, James E.; Senese, Frederick; Jespersen, Neil D. (2007). 화학 :물질과 그 변화 . John Wiley &Sons. ISBN 9780470120941.
- Giunta, Carmen J. (2016). “이름에 무엇이 있습니까? 물질, 화학량 및 화학량 론적 양의 양.” J. Chem. 교육. 93 (4) :583-586. doi :10.1021/acs.jchemed.5B00690
- olmsted, John; Williams, Gregory M. (1997). 화학 :분자 과학 . Jones &Bartlett 학습. ISBN 0815184506.
- Zumdahl, Steven S. (2006). 화학 원리 (제 4 판). 뉴욕 :Houghton Mifflin Company. ISBN 0-618-37206-7.