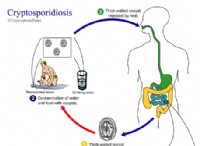
1. 균형 화학 방정식을 작성하십시오 :
붕산 (BOH3)의 붕산 산화물 (B2O3) 및 물 (H2O)의 분해는 다음 방정식으로 표시됩니다.
2 BOH3 → B2O3 + 3 H2O
2. BOH3 및 B2O3 :의 몰 질량을 계산하십시오
* BOH3의 어금니 질량 =10.81 (b) + 3 * (1.01 + 16.00) =61.84 g/mol
* B2O3의 어금니 질량 =2 * 10.81 (b) + 3 * 16.00 (O) =69.62 g/mol
3. BOH3의 질량을 두더지로 변환하십시오.
* BOH3의 두더지 =10 g / 61.84 g / mol =0.1617 mol
4. 균형 방정식의 두더지 비율을 사용하여 B2O3의 두부를 찾으십시오. .
* 균형 방정식에서 2 몰의 BOH3은 1 몰의 B2O3을 생성합니다.
* B2O3의 두더지 =(0.1617 mol boh3) * (1 mol b2o3 / 2 mol boh3) =0.08085 mol b2o3
5. B2O3의 두더지를 그램으로 변환하십시오 :
* B2O3의 질량 =0.08085 mol * 69.62 g/mol =5.63 g
따라서, 5.63 g의 붕소 산화물 (B2O3)은 10g의 붕산 (BOH3)의 분해로부터 형성된다. .