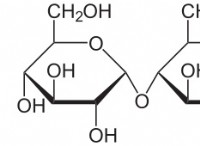
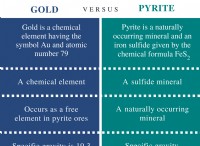
다음은 고장입니다.
이산화황 (So₂) :
* 기하학 : 구부러진 (또는 V 자형)
* 극성 : 극선
* 설명 : 황 원자는 2 개의 산소 원자가 그것에 부착되어 있고, 황 원자의 고독한 쌍은 왜곡 된 형상을 만듭니다. 전자 밀도 의이 고르지 않은 분포는 쌍극자 모멘트를 초래하여 분자를 극성으로 만듭니다.
이산화탄소 (CO₂) :
* 기하학 : 선의
* 극성 : 비극성
* 설명 : 탄소 원자는 선형 기하학을 갖는 2 개의 산소 원자에 결합된다. 탄소와 산소 사이의 전기 음성 차이는 분자 내에서 극성 결합을 생성합니다. 그러나 두 극성 결합은 동일하고 반대이며 효과적으로 서로를 취소합니다. 이것은 비극성 분자를 초래합니다.
키 테이크 아웃 :
* 분자 형상 : 분자의 모양은 극성을 결정하는 데 중요한 역할을합니다.
* 전기 음성 차이 : 원자 사이의 전기 음성 성의 차이는 개별 결합의 극성을 결정합니다.
* 쌍극자 취소 : 대칭 분자에서, 개별 결합이 극성이더라도, 쌍극자의 취소로 인해 전체 분자가 비극성이 될 수있다.
극성과 화학적 결합에 대한 다른 질문이 있으면 알려주세요!