주요 개념 :
* 전자 쌍 : VSEPR은 결합 쌍 (공유 결합과 관련된) 및 고독한 쌍 (비 결합 전자)을 포함하여 중앙 원자 주변의 모든 전자 쌍을 고려합니다.
* 반발 : 전자 쌍은 서로를 격퇴 하고이 반발을 최소화하기 위해 스스로를 마련하려고 노력합니다. 이것은 그들이 가능한 한 멀리 떨어져있을 것임을 의미합니다.
* 기하학 : 전자 쌍의 배열은 분자의 전체 형상 또는 형상을 결정합니다.
VSEPR 이론이 우리에게 말하는 것 :
1. 모양 예측 : VSEPR 이론은 분자의 분자 형상 (모양)을 예측하는 데 도움이됩니다. 예를 들어, 그것은 우리에게 다음을 알려줍니다.
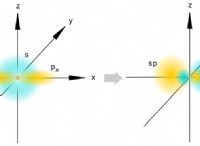
* 중앙 원자 주위에 2 개의 전자 쌍이있는 분자는 선형 모양을 갖습니다 (예 :Becl 2 ).
* 중앙 원자 주위에 4 개의 전자 쌍이있는 분자는 사면형 모양을 갖습니다 (예 :ch 4 ).
2. 결합 각도 : VSEPR 이론은 분자의 원자 사이의 대략적인 결합 각도를 예측하는 데 도움이됩니다. 예를 들어, 사면체 분자에서 결합 각은 약 109.5 °입니다.
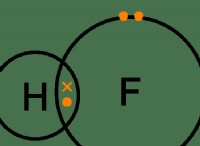
3. 고독한 쌍의 효과 : 고독한 전자 쌍은 결합 쌍보다 더 강한 반발 효과를 갖는다. 이것은 고독한 쌍을 가진 분자가 결합 쌍 만있는 분자에 비해 약간 왜곡 된 형상을 가질 것임을 의미합니다. 예를 들어, 물 (h 2 o)는 산소 원자에 2 개의 고독한 쌍이있어 H-O-H 결합 각도가 109.5 ° (약 104.5 °) 미만입니다.
4. 극성 : VSEPR 이론은 또한 분자의 극성을 이해하는 데 도움이 될 수 있습니다. 전자 쌍이 중앙 원자 주위에 비대칭으로 배열되면 분자는 극성이됩니다. 이것은 분자의 한쪽이 부분 양전하를 가질 것이며 다른 쪽은 부분 음전하를 갖는다는 것을 의미합니다.
한계 :
VSEPR 이론은 분자 모양을 예측하기위한 강력한 도구이지만 몇 가지 한계가 있습니다.
* 복합 분자 : 더 크고 더 복잡한 분자, 특히 다수의 중앙 원자가있는 분자에 대해서는 덜 정확해진다.
* 본딩 : VSEPR은 원자 사이의 결합 (단일, 이중 또는 트리플)의 특성을 고려하지 않으며, 이는 기하학에 영향을 줄 수 있습니다.
전반적으로 :
VSEPR 이론은 분자의 모양과 그 특성을 이해하기위한 간단하고 유용한 모델을 제공합니다. 화학의 기본 개념이며 화학 반응 이해, 물리적 특성 예측 및 새로운 재료 설계를 포함하여 다양한 응용 분야에서 사용됩니다.