주요 차이 - SP 대 SP vs SP Hybridization
궤도는 전자로 채워질 수있는 가상 구조입니다. 다른 발견에 따르면, 과학자들은이 궤도에 대해 다른 모양을 제안했습니다. 궤도에는 원자 궤도, 분자 궤도 및 하이브리드 궤도의 세 가지 주요 유형이 있습니다. 원자의 원자 궤도는 화학적 결합에 적합한 궤도를 만들기 위해 혼성화를 겪습니다. 화학에서, 혼성화는 상이한 원자 궤도의 혼합을 위해 혼성 궤도를 형성하는 것이다. SP, SP 및 SP 하이브리드 궤도와 같은 다른 형태의 하이브리드 궤도를 만드는 다양한 형태의 하이브리드 화가 있습니다. 이러한 궤도는 상이한 비율로 S 및 P 원자 궤도의 혼성화에 의해 형성된다. SP SP와 SP 혼성화의 주요 차이점은 SP 하이브리드 화는 50% S 궤도 특성을 갖는 하이브리드 궤도를 형성하고 SP 하이브리드 화는 33% 궤도 특성을 갖는 하이브리드 궤도를 형성하는 반면 SP 하이브리드 화는 25% S 궤도 특성을 갖는 하이브리드 궤도를 형성한다는 것이다.
주요 영역을 다루었습니다
1. SP 하이브리드 화
- 정의, S 및 P 특성 계산, 기타 기능
2. SP 하이브리드 화
- 정의, S 및 P 특성 계산, 기타 기능
3. SP 하이브리드 화
- 정의, S 및 P 특성 계산, 기타 기능
4. SP SP와 SP 하이브리드 화의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자 궤도, 하이브리드 궤도, 하이브리드 화, 궤도, SP 혼성화, 스핑 브리드 화, 꼭대기
sp 하이브리드 화
sp hybridization은 S 원자 궤도와 p 원자 궤도 사이에서 발생하는 혼성화입니다. 전자 쉘은 3 개의 p 궤도를 함유한다. 따라서, 이들 P 궤도 중 하나로 s 궤도의 혼성화 후, 그 원자에 존재하는 2 개의 UN- 하이브리드화 된 p 궤도가 존재한다. 여기서 우리는 모든 s와 p 궤도를 원자 궤도 (S+P)로 간주합니다. S와 P 궤도의 비율은 1 :1입니다. 따라서 S 궤도의 분획은 1/2이고, p 궤도의 분획은 1/2입니다.
s (또는 p) 특성 백분율 =총 원자 궤도 x (1/2) x 100%
=50%
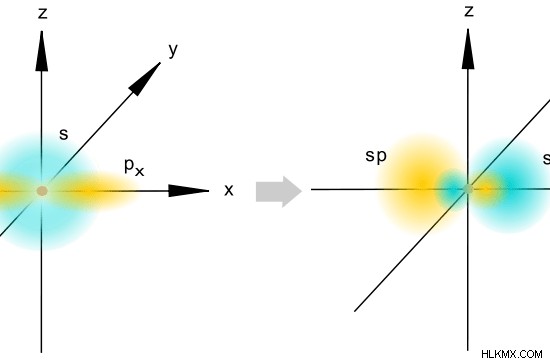
그림 1 :SP 혼성화
결과 하이브리드 궤도의 특성의 50%와 P 특성의 50%가 있습니다. 단지 2 개의 하이브리드 궤도 만 형성되기 때문에, SP 궤도의 공간 배열은 선형이다. 두 하이브리드 궤도는 반대 방향으로 향합니다. 따라서,이 궤도 사이의 각도는 180c입니다.
스 공간화
sp hybridization은 하나의 원자 궤도와 2 개의 p 원자 궤도를 혼합하는 것입니다. 새로 형성된 하이브리드 궤도는 SP 하이브리드 궤도로 알려져 있습니다. 결과 하이브리드 궤도는 S 문자의 약 33.33%와 P 문자의 약 66.66% 를가집니다. 이는 총 3 개의 원자 궤도가 하이브리드 화에 관여하고 S 및 P 특성의 백분율은 다음과 같이 다양하기 때문입니다.
여기서, 우리는 모든 s와 p 궤도를 원자 궤도 (s+p+p)로 간주합니다. S와 P 궤도의 비율은 1 :2입니다. 따라서, s 궤도의 분율은 1/3이고 p 궤도의 분획은 2/3이다.
s 특성 비율 =총 원자 궤도 x (1 /3) x 100 %
=33.33 %
p 특성 비율 =총 원자 궤도 x (2 /3) x 100 %
=66.66 %
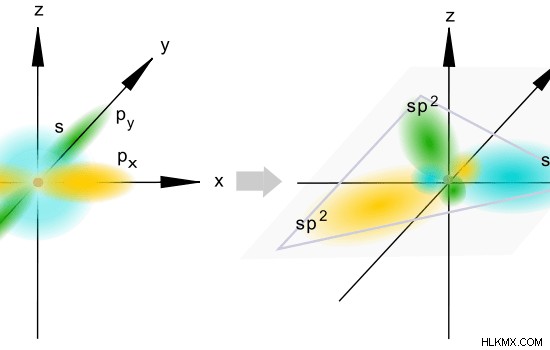
그림 2 :SP 혼성화
SP 하이브리드 궤도의 공간 배열은 삼각 평면입니다. 따라서,이 궤도 사이의 각도는 120C이다. 이 하이브리드 화를 겪는 원자에는 3 개의 p 궤도 중 2 개만 이이 하이브리드 화에 관여하기 때문에 1 개의 비 하이브리드화 된 p 궤도가 있습니다.
SP 하이브리드 화가란 무엇입니까
sp hybridization은 하나의 원자 궤도와 3 개의 p 원자 궤도를 혼합하는 것입니다. 여기서, 원자는 3 개의 p 궤도 모두가 혼성화에 관여하기 때문에, 하이브리드화 된 p 궤도가 없다. 결과 궤도는 SP 하이브리드 궤도로 알려져 있습니다. 포자와 마찬가지로이 궤도의 S와 P 특성을 계산할 수 있습니다.
sp 하이브리드 화에서 우리는 모든 s와 p 궤도를 원자 궤도 (s+p+p+p)로 간주합니다. S와 P 궤도의 비율은 1 :3입니다. 따라서, s 궤도의 분율은 ¼이고, p 궤도의 분획은 ¾이다.
s 특성 백분율 =총 원자 궤도 x (1/4) x 100 %
=25 %
p 특성 백분율 =총 원자 궤도 x (3/4) x 100 %
=75 %
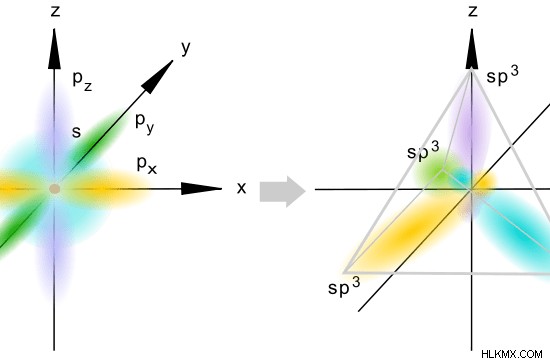
그림 3 :SP 혼성화
이 궤도는 하나의 궤도와 3 p 궤도가 혼성화 될 때 형성됩니다. 결과 하이브리드 궤도는 S 문자의 약 25%와 P 특성의 약 75% 를가집니다. 이 궤도의 공간 배열은 사면체입니다. 따라서,이 궤도 사이의 각도는 109.5C입니다.
SP SP와 SP 혼성화 간의 차이
정의
SP 혼성화 : SP 하이브리드 화는 원자 궤도와 P 원자 궤도 사이에서 발생하는 혼성화입니다.
SP 혼성화 : SP 혼성화는 하나의 원자 궤도와 2 개의 p 원자 궤도를 혼합하는 것입니다.
SP 혼성화 : SP 혼성화는 하나의 원자 궤도와 3 개의 p 원자 궤도를 혼합하는 것입니다.
의 특성
SP 혼성화 : SP 하이브리드 궤도의 특성 비율은 50%입니다.
SP 혼성화 : SP 하이브리드 궤도의 특성 비율은 33.33%입니다.
SP 혼성화 : SP 하이브리드 궤도의 특성 비율은 25%입니다.
H 하이브리드 궤도의 특성 비율
SP 혼성화 : SP 하이브리드 궤도의 P 특성 비율은 50%입니다.
SP 혼성화 : SP 하이브리드 궤도의 특성 비율은 66.66%입니다.
SP 혼성화 : 스 공간 궤도의 특성 비율은 75%입니다.
궤도 사이의 각도
SP 혼성화 : SP 궤도 사이의 각도는 180 ° C입니다.
SP 혼성화 : 포자 사이의 각도는 120 ° C입니다.
SP 혼성화 : 포자 사이의 각도는 109.5 ° C입니다.
기하학
SP 혼성화 : SP 혼성화에서 궤도 배열의 형상은 선형입니다.
SP 혼성화 : 스 공간화에서 궤도 배열의 형상은 삼각 평면입니다.
SP 혼성화 : 스 공간화에서 궤도 배열의 기하학은 사면체입니다.
UN- 하이브리드 궤도의 수
SP 혼성화 : SP 하이브리드 화는 2 개의 UN- 하이브리드 화 된 p 궤도를 초래한다.
SP 혼성화 : SP 하이브리드 화는 하나의 UN- 하이브리드화 된 P 궤도를 초래한다.
SP 혼성화 : SP 하이브리드 화는 비-하이브리드화 된 p 궤도를 초래하지 않습니다.
결론
화학의 하이브리드 화는 서로 다른 특성을 갖는 새로운 하이브리드 궤도를 형성하기 위해 다른 원자 궤도의 혼합을 나타냅니다. SP, SP 및 SP 혼성화가 그러한 예입니다. SP, SP 및 SP 혼성화의 주요 차이점은 SP 하이브리드 화가 50% S 궤도 특성을 갖는 하이브리드 궤도를 형성하고 SP 하이브리드 화는 33% S 궤도 특성을 갖는 하이브리드 궤도를 형성하는 반면 SP 하이브리드 화는 25% S orbital 특성을 갖는 하이브리드 궤도를 형성한다는 것이다.
.참조 :
1.“하이브리드 궤도.” 화학 LibreTexts, LibreTexts, 2016 년 7 월 21 일, 여기에서 구할 수 있습니다.
2. "궤도 혼성화." Wikipedia, Wikimedia Foundation, 2018 년 1 월 15 일, 여기에서 구입할 수 있습니다.
이미지 제공 :
1. Joanna Kośmider의“Hybrydyzacja SP” - Commons Wikimedia
2를 통한 자신의 작업 (공개 도메인). Joanna Kośmider의“Hybrydyzacja SP2” - Commons Wikimedia
3을 통한 자신의 작업 (공개 도메인). Joanna Kośmider의“Hybrydyzacja SP3” - Commons Wikimedia를 통해 자신의 작업 (공개 도메인)